1. 서 론
2. 연구 방법
2.1 연구대상지
2.2 시료 채취
2.3 혼합대 모사 컬럼 실험 방법
3. 연구 결과 및 고찰
3.1 현장 시료 물리화학적 특성 분석 결과
3.2 상향류 흐름에 따른 혼합대 내 수질 변화
3.3 하향류 흐름에 따른 혼합대 내 수질 변화
4. 결 론
1. 서 론
혼합대(hyporheic zone)란 지하수와 지표수의 흐름 교환 및 혼합이 발생하는 호소, 하천, 연안 등의 퇴적물(sediment) 또는 지층과 같은 하상 경계층 영역을 의미한다(Findlay 1995). 혼합대에서는 다양한 수문학적(hydrologic), 생지화학적(biogeochemical) 과정이 복합적으로 발생하며, 혼합대의 수두구배, 화학적 구배(용존산소, pH 등), 지형 등의 특성에 따라 퇴적물 내 매질과 미생물의 접촉을 증가시켜 생태계의 물질전달과 상호작용에 큰 영향을 미친다(Boulton et al. 1998, Holmes 2000, Kim et al. 2006, Cardenas 2015). 이러한 다양하고 복잡한 과정에 의해 지하수 및 지표수가 혼합대를 통과하는 경우 오염물질이 자연적으로 저감되어 수질이 개선된다고 지속적으로 보고되고 있다(Poole et al. 2006, Peralta-Maraver et al. 2018).
혼합대는 지표수와 지하수의 충분한 흐름 교환이 발생하며, 오염물질이 저감되는 반응 기작이 발생할 수 있을 만큼의 긴 체류시간과 빠른 반응속도를 만족하여 오염물질 저감에 기여하는 생지화학적 기작이 발생하기 용이하다(Hyun and Kim 2013). 일반적으로 혼합대에서 오염물질을 저감시키는 과정은 수문학적 측면에서 지표수가 하상 퇴적물로 침투(infiltration)하여 지표수의 오염물질이 유속이 비교적 느린 퇴적물에 체류하며 농도가 저감되는 일시 저장(transient storage)이 있다. 또한 비생물학적 측면에서 지표수 및 지하수의 오염물질이 퇴적물과 대수층(aquifer)의 고형물 표면에 부착되는 흡착(sorption), 생물학적인 측면에서 혼합대 내 존재하는 조류, 박테리아, 미생물 등의 분해 및 발효에 의해 발생하는 생물 흡수(biotic uptake)로 구분할 수 있다(Triska et al. 1994, Fernald et al. 2001, Battin et al. 2016, Schaper et al. 2019). 이러한 과정을 통해 혼합대(퇴적물과 대수층)에서 자연적으로 저감되는 것으로 알려진 오염물질은 영양염류, 중금속, 유기오염물질(DOM, POM) 등이 있으며, 특히 혼합대는 질소의 변환 및 저감의 주요 지점으로 질소 순환에 큰 영향을 미치는 것으로 보고되고있다(Zhao et al. 2021).
혼합대에서 질소의 순환은 주로 미생물에 의한 생물학적 산화-환원(oxidation-reduction) 반응을 통해 이루어진다(Xia et al. 2018). 질소의 산화 과정에는 미생물에 의해 유기 질소가 질산화의 반응물인 암모늄으로 변환되는 암모니아화(ammonification)와 질산화(nitrification), 혐기성 암모늄 산화(anaerobic ammonium oxidation, anammox)가 있고, 질소의 환원 과정으로는 질소 고정(nitrogen fixation), 질소 동화(nitrogen assimilation), 탈질(denitrification), 이화적 질산염 환원(dissimilatory nitrate reduction to ammonium, DNRA) 등이 있다(Strock 2008, Zhou et al. 2014). 일반적으로 보고되고 있는 호소 및 혼합대 내 질소의 순환을 Fig. 1에 제시하였다.
이러한 생물학적 질소 순환 과정에서 미생물의 성장에 pH, 용존산소(DO), 온도, 기질 농도(substrate concentration), 탄소원(carbon sources) 등의 다양한 인자들이 영향을 미친다. 이러한 인자들 이외에도 van Dijk et al. (2017)과 Jiang et al. (2021)는 최근 기후변화에 따른 해수면 상승으로 인해 해수침투 및 호소수 증발 등이 발생하여 염분화(salinization)가 촉진되어 다양한 생태 및 수질 문제가 야기되므로 염분(salinity) 또한 미생물 성장의 주요한 영향 인자로 고려되고 있다고 보고하였다. 염분은 미생물의 대사와 군집 분포 및 유전자 성상에 복잡한 영향을 미쳐 미생물의 성장과 변이 등의 변화를 일으키므로(Wang et al. 2018, Feng et al. 2023), 염분화 된 호소의 질소 거동을 분석하는 경우 염분의 영향을 필히 고려해야 한다.
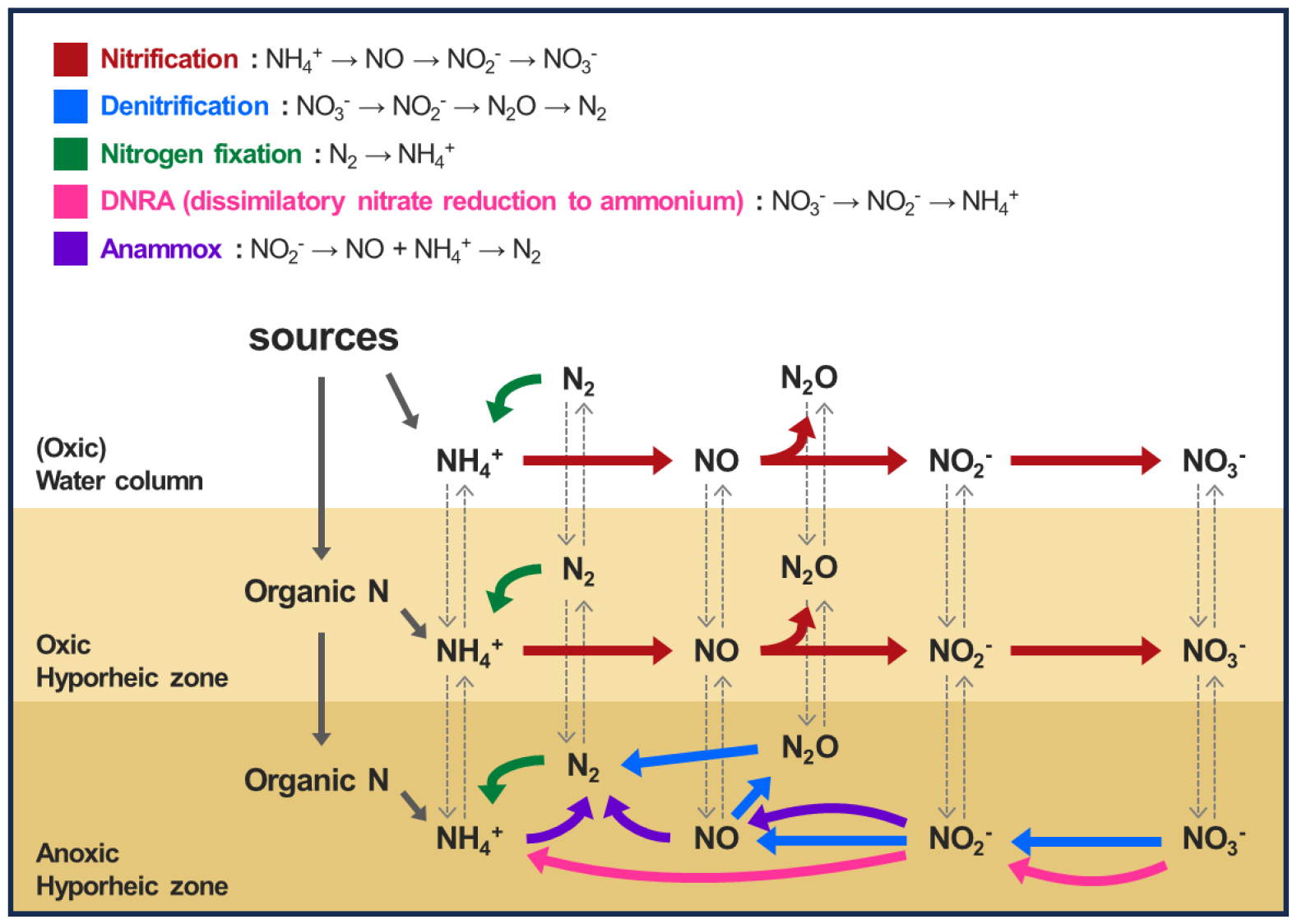
Fig. 1.
Nitrogen cycle using complex microbial processes through hyporheic zone (modified from Ray et al. 2021).
본 연구에서는 염분에 의해 영향을 받는 기수호 내 혼합대의 질소 거동을 분석하기 위하여 현장 지표수, 지하수, 퇴적물, 대수층 충진재를 이용하여 pilot scale의 혼합대 모사 실험을 진행하였다. 실험은 상향류의 지하수가 지표수로 용승하는 이득호소와 하향류의 지표수가 지하수에 유입되는 손실호소를 모사하여 각각의 실험을 진행하였다.
2. 연구 방법
2.1 연구대상지
본 연구의 연구 대상지인 강원도 고성군 죽왕면에 위치한 송지호는 모래가 퇴적되어 해안으로부터 분리되며 형성된 석호(lagoon)로 하구와는 구별된 생태특성을 나타낸다(Kwak et al. 2005) (Fig. 2). 송지호는 좁은 수로로 연결된 내호(북호)와 외호(남호)로 이루어져 있으며(Lee and Yu 2011), 담수는 대부분 강수 또는 호소 주변부의 지하수와 하천수로 유입되고 염수는 해안의 파랑과 같은 자연 현상 및 투수성이 높은 모래층을 통하여 자연 유입되는 담수와 염수가 혼합된 기수 환경을 나타낸다(Jeon et al. 2021).
2.2 시료 채취
송지호의 혼합대를 모사하기 위해 현장의 지표수, 지하수, 퇴적물 및 대수층 충진재를 채수 및 채취하였다. 송지호의 퇴적물은 호소 유입부에서 패각 잔해 등이 섞인 입자가 굵은 조립질 형태이며, 호소 중심부에서는 오염도가 비교적 높으며 점토질 실트(clayey silt)로 구성되어 있다. 본 연구에서는 오염도가 높은 송지호 내호 중심부의 퇴적물을 Petite ponar grab (Wildco, USA)을 이용하여 산란을 일으키지 않도록 주의하며 채취하였다. 지표수의 경우 퇴적물과 동일한 위치에서 퇴적물과의 거리가 10 cm 이내로 근접하도록 Van dorn water sampler (RIGO, Japan)를 이용하여 채수하였다. 지하수는 호소 인근 지하수 관정 내에 포집된 물을 Peristaltic pump (Longer, UK)를 사용하여 양수하였다. 대수층 충진재의 경우 지하수 관정 근처의 깊이 1 m 이상의 토양을 선별하여 채취하였다. 채취한 시료는 교란을 방지할 수 있도록 밀봉하여 4°C 이하에서 운반 및 보관하였다.
2.3 혼합대 모사 컬럼 실험 방법
2.3.1 투수성 증대를 위한 퇴적물의 혼합
예비실험을 통해 현장에서 채취한 불투수성 퇴적물(Kh≤10-5 cm/s)에서 높게 발생하는 손실수두(head loss)로 인해 실험실 내에서 혼합대 현장 모사 실험이 불가한 것으로 조사되었다. 따라서 비교적 투수성이 증대된 혼합대를 조성하기 위해 불투수성 퇴적물과 투수성 대수층 충진재를 혼합한 혼합 퇴적물로 현장 퇴적물을 대체하였으며, 혼합비율은 퇴적물과 대수층 충진재의 투수계수를 고려하여 결정하였다.
퇴적물과 대수층 충진재를 혼합한 혼합 퇴적물의 경우 현장 퇴적물에 비해 오염도가 낮은 대수층이 혼합되어 질소계 오염원의 농도가 희석된다. 따라서 현장에서 측정된 퇴적물의 질소계 오염물질 농도를 고려하여 25% 암모니아수(NH3)를 혼합 퇴적물에 주입 및 교반하였다.
이득호소의 경우 기수호 내 지속적인 오염물질의 퇴적과 가뭄 조건을 모사하여 NH4+ 농도를 최대 73 mM로 설정하였으며, 손실호소의 경우 호소 수위 상승으로 오염 물질의 희석을 모사하여 암모니아 농도를 1.36 mM로 설정하였다.
2.3.2 상향류 및 하향류 컬럼 실험 방법
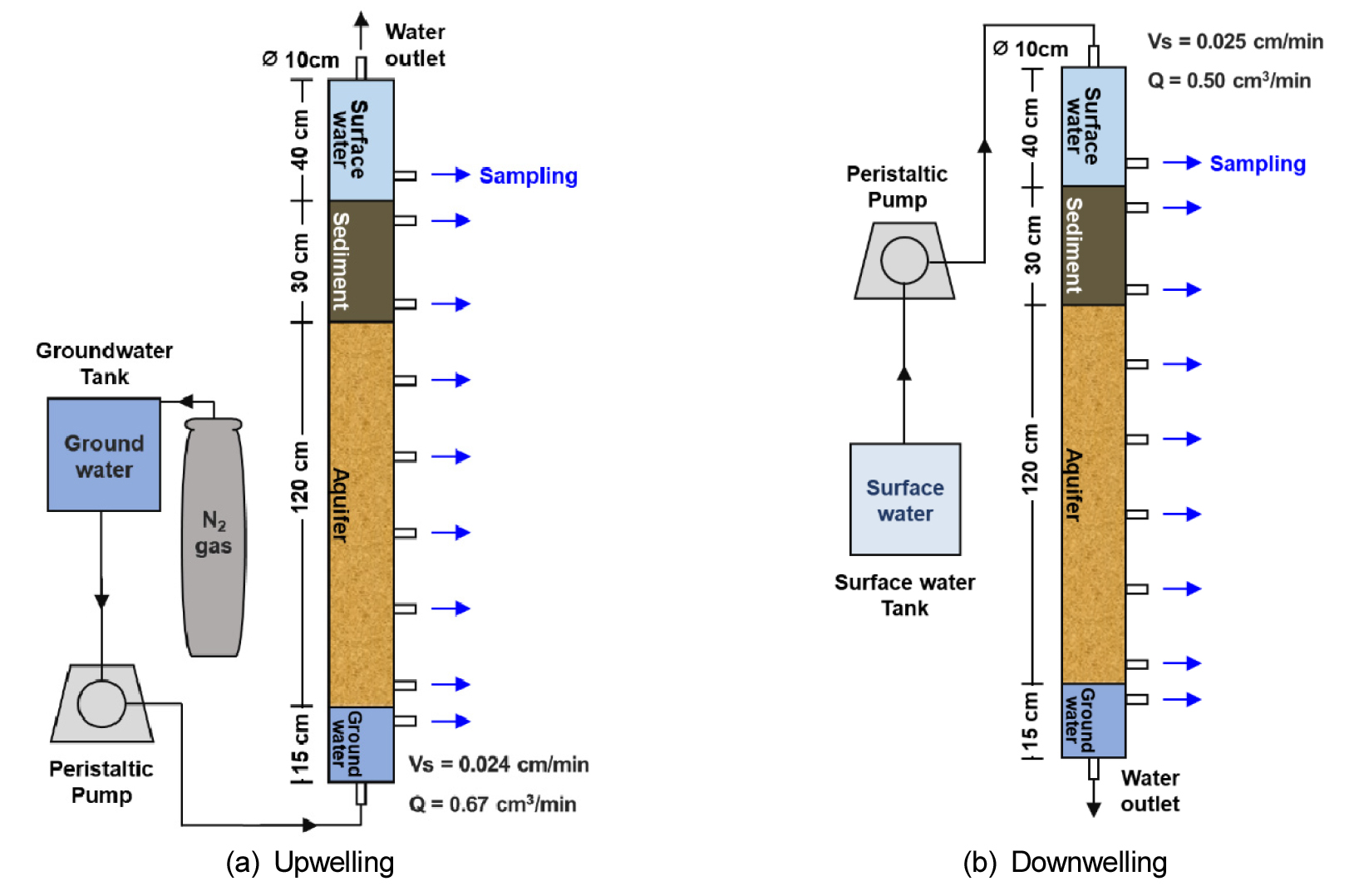
Pilot scale로 혼합대를 모사하기 위한 컬럼 실험 개요도를 Fig. 3에 제시하였다. 길이(L)가 2.05 m, 지름(D)이 0.1 m인 아크릴 재질의 원통형 컬럼에 대수층 충진재를 높이(H) 1.2 m로 충전하고 대수층을 하단 지하수 수조(reservoir)로부터 상향류로 채웠다. 대수층 위로 혼합 퇴적물을 높이 0.3 m 만큼 충전한 후 상단 지표수 수조를 통해 교란이 일어나지 않게 유의하며 지표수를 채웠다.
혼합대의 질소 순환에 관여하는 물리적, 생지화학적 기작은 온도 변화에 민감하게 영향을 받으므로(Zheng et al. 2016, Zheng et al. 2018), 항온 상태에서 실험이 진행될 수 있도록 순환식 항온 수조(Jeiotech, South Korea)을 이용하였다. 항온 수조 튜브를 컬럼의 대수층 부분 외부에 피복하고 PET 소재의 단열재를 컬럼 외부에 추가적으로 피복하여 지표수와 퇴적물은 20°C, 대수층과 지하수는 10 - 15°C로 유지시켰다.
혼합대 내 지하수 및 지표수의 혼합은 복잡한 공간적 및 계절적 변화에 따라 지하수가 지표수로 용출되는 상향류(upwelling)의 이득호소와 지표수가 지하수로 유출되는 하향류(downwelling)의 손실호소가 교대로 발생할 수 있다(Thibodeaux et al. 1987). 이러한 흐름의 변화로 인해 혼합대의 수직적 범위, pH, 온도 등이 지속적으로 변화하므로(Boulton 1993, Williams et al. 2010, Kaufman et al. 2017), 혼합대 내 물의 흐름 방향에 따른 질소 거동을 분석하기 위해 상향류와 하향류의 실험을 컬럼 구성 및 항온 조건이 동일한 방식으로 각각 진행하였다.
Fig. 3에 제시되었듯이 상향류 실험은 연동펌프(LeadFluid, China)를 이용하여 지하수를 유량(Q) 0.67 cm3/min, 공극유속(Vs)을 0.024 cm/min으로 흘려주었으며, 하향류 실험은 지표수를 유량 0.50 cm3/min, 공극유속을 0.025 cm/min으로 흘려주었다. 실험은 상향류와 하향류 각각 720 시간동안 진행하였으며, 48시간마다 9개의 시료 추출부(sampling port)를 통해 30 mL씩 채수한 후 0.45 μm 친수성 PTFE 필터를 이용하여 여과한 후 분석하였다.
2.3.3 분석 방법
퇴적물의 총질소(T-N)와 NH4+는 Kjeldahl 법으로 전처리한 후 비색법을 이용하여 분석하였으며, 총인(T-P)은 수분함량은 토양오염공정시험기준에 의거하여 퇴적물을 왕수로 산분해 전처리하고 용액을 원자화한 후 원자흡수분광광도법으로 분석하였다. Cl-, SO42-와 같은 음이온은 1:5 추출법으로 이온크로마토그래피를 이용하여 분석하였다. 염분 농도는 전기전도도(electrical conductivity; EC) 측정기를 이용하여 측정하였다.
채수한 시료는 다항목 수질측정기를 이용하여 수온, DO, pH, 산화환원전위(oxidation reduction potential; ORP), 전기전도도, 총용존고형물(total dissolved solids; TDS)을 측정하였다. NH3-N은 UV-Vis 분광광도계(KLAB, South Korea)을 이용하여 인도페놀법으로, NO2-, NO3-는 이온크로마토그래피(Metrohm, Switzerland)를 통해 수질오염공정시험기준에 부합하게 분석하였다.
3. 연구 결과 및 고찰
3.1 현장 시료 물리화학적 특성 분석 결과
실험에 사용된 송지호의 현장 퇴적물과 대수층의 물리화학적 특성 분석 결과를 Table 1에 제시하였다. 총질소(total nitrogen) 농도는 퇴적물에서 4,900 mg/kg, 대수층에서 690 mg/kg으로 나타났으며, NH4+ 농도는 퇴적물에서 25.9 mg/kg, 대수층에서 검출한계 미만으로 존재하여 퇴적물이 대수층에 비해 더 많은 양의 질소화합물을 함유하고 있음을 확인하였다. 염분 농도의 경우 퇴적물에서 9%, 대수층에서 0.02%로 퇴적물에서 비교적 높게 나타났으며, 높은 염분 농도로 인해 퇴적물의 Cl- 및 SO42-농도 또한 각각 55,871 mg/kg, 4,303 mg/kg으로 대수층에 비해 높게 나타나는 것을 확인하였다. 함수율의 경우 퇴적물에서 80.4%, 대수층에서 17%로 실트질의 퇴적물의 함수율이 더 높게 나타났다.
Table 1.
Physico-chemical properties of sediment and aquifer in Songji lagoon
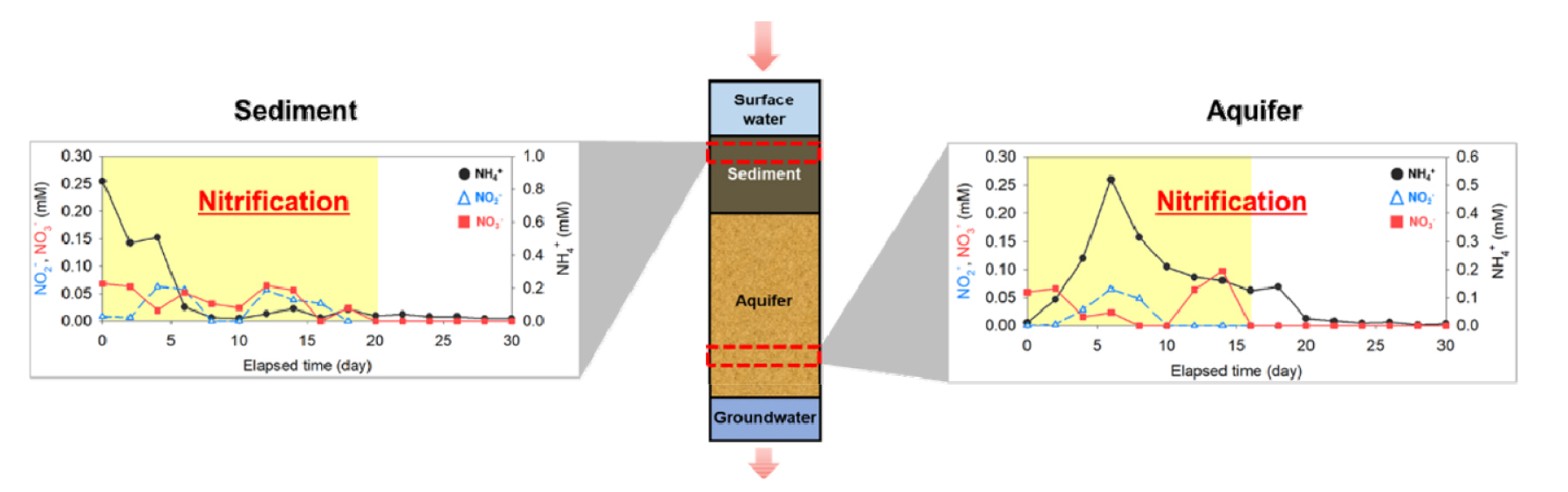
현장 지표수와 지하수 농도는 Table 2에 제시하였다. 질소계 화합물의 경우 NH4+는 지표수에서 0.94 mg/L, 지하수 0.054 mg/L로 지표수가 더 높게 나타났다. 이는 퇴적물에 흡착되어 있던 NH4+의 극성을 지표수의 높은 염분 농도가 중화시켜 NH4+가 퇴적물에서 지표수로 탈착되며 나타난 현상으로 판단된다(Gardner et al. 1991). NO3-의 경우 지표수에서 0.11 mg/L, 지하수에서 1.897 mg/L로 지하수에서 더 높은 값을 나타냈다. 이는 송지호의 주변이 대부분 농업용지로 이루어져 있어, 농업용 비료에 의해 지하수의 NO3- 농도가 높게 나타난 것으로 판단된다. Cl-은 지표수에서 6,336 mg/L로 지하수(323 mg/L) 대비 높게 분석되었으며, 이는 지표수에 파랑 또는 모래를 통한 해수의 유입이 주기적으로 발생하기 때문인 것으로 추정된다.
Table 2.
Physico-chemical properties of surface water and groundwater in Songji lagoon
3.2 상향류 흐름에 따른 혼합대 내 수질 변화
3.2.1 이화학적 지표 농도 변화
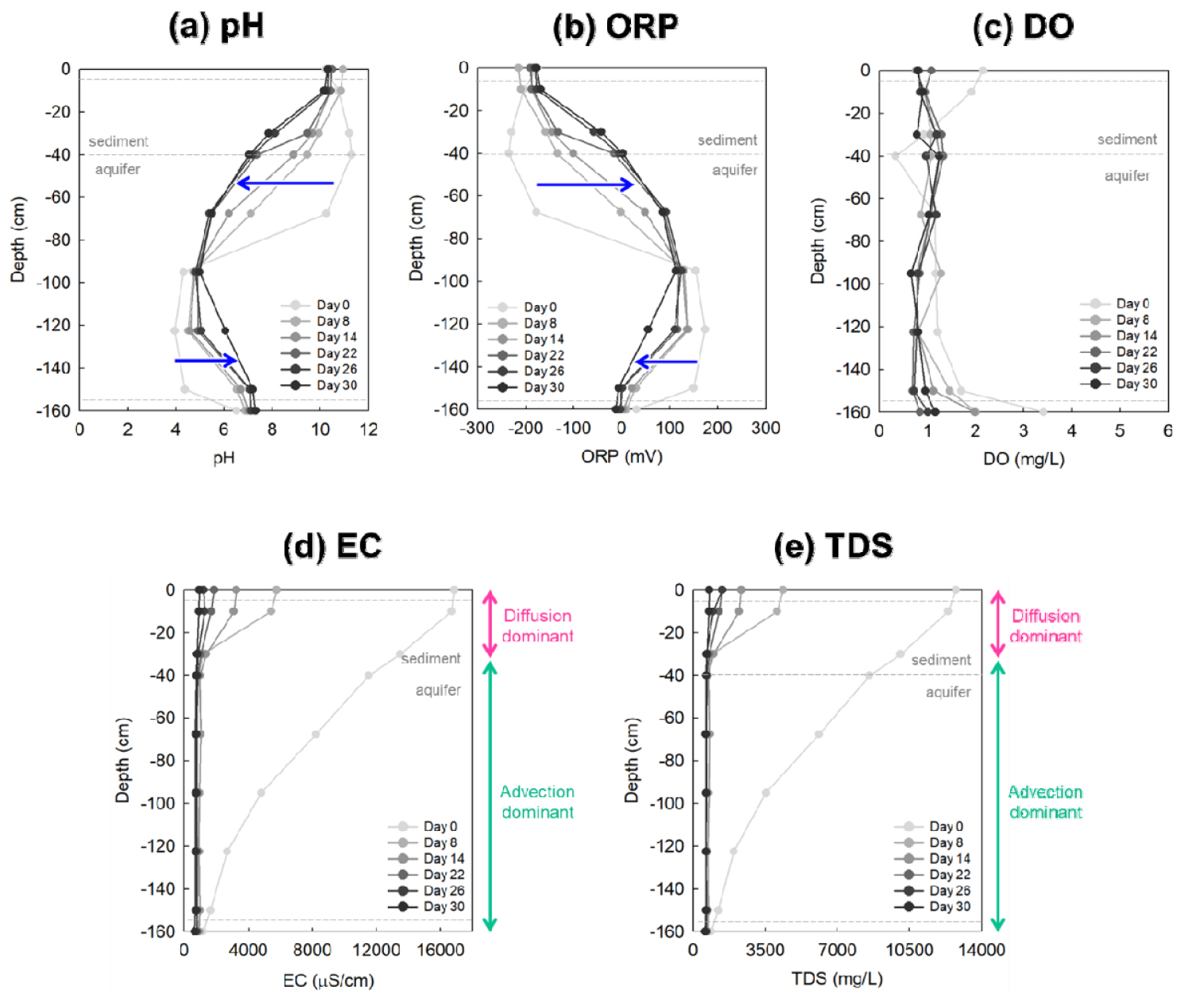
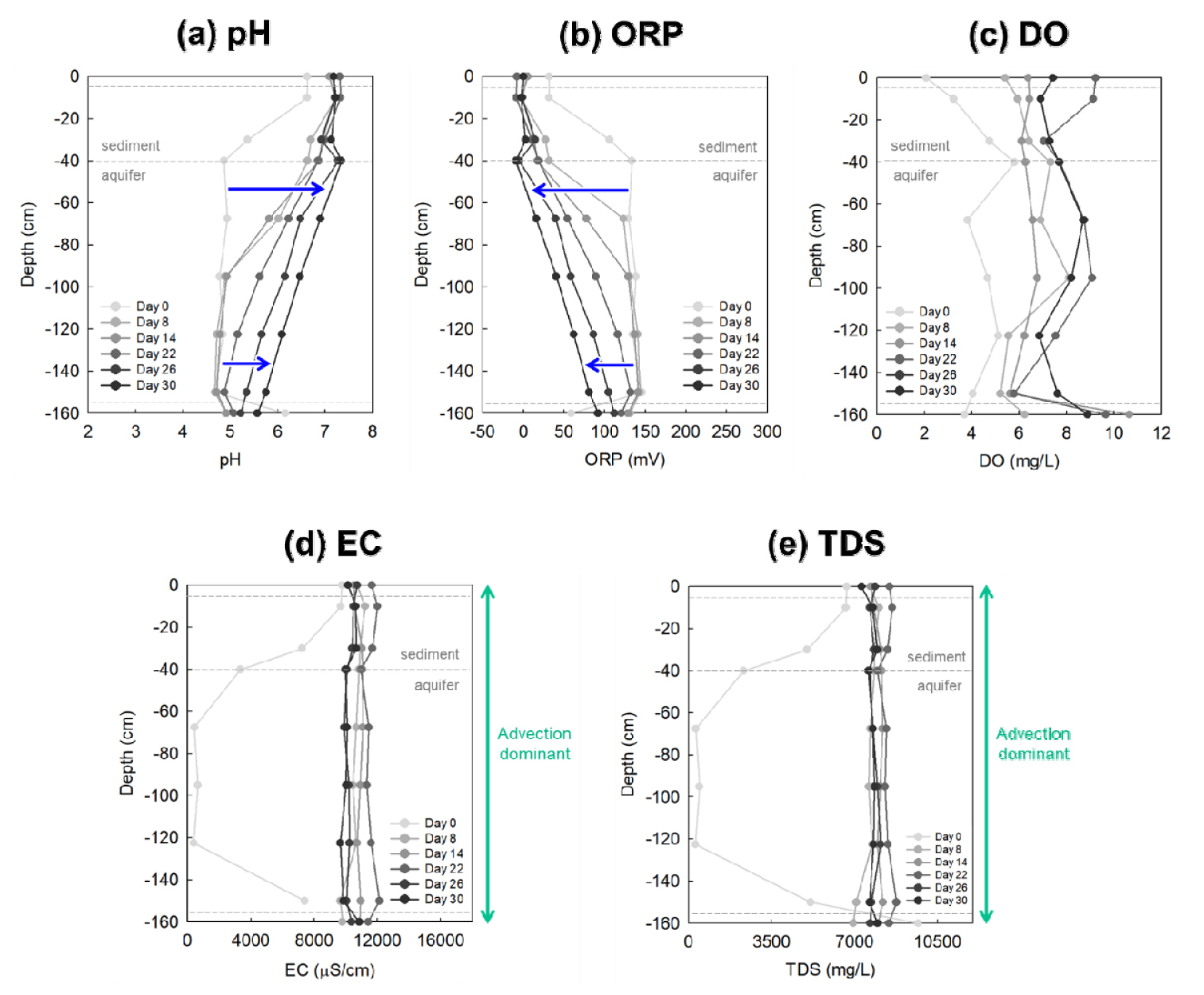
상향류 컬럼의 이화학적 수질 변화를 Fig. 4에 제시하였다. 지하수가 컬럼을 통해 상향류로 흐름에 따라 퇴적물 및 대수층의 이화학적 지표 농도 profile이 시간 경과와 함께 지하수의 이화학적 지표와 비교적 유사하게 변화하는 것으로 나타났다. 일반적으로 질산화와 탈질은 pH에 의해 제어되어 질산화는 pH 6 - 9에서, 탈질은 pH 5 - 9.5의 비교적 넓은 범위에서 발생하는 것으로 알려져 있다(Loehr 1984, Holt et al. 1994). 본 연구에서는 시간이 경과함에 따라 퇴적물은 초기 농도 pH 10 이상에서 pH 6 - 8로 변화하였고, 대수층은 pH 4에서 pH 6 - 8로 변화하여 질산화 및 탈질 미생물의 활성도가 높아지는 적정 pH로 변화한 것을 확인하였다. ORP도 pH와 마찬가지로 지하수의 흐름에 따라 퇴적물은 산화조건으로, 대수층은 환원조건으로 변화하는 것을 확인하였다.
낮은 용존 산소 농도를 가진 지하수가 대수층과 퇴적물을 통과하여 지표수로 용출하는 경우 혼합대 내에서 2 mg/L 이하의 비교적 낮은 용존 산소 농도를 유지하였다. 초기 퇴적물과 지표수 경계면에서 비교적 높은 용존산소 농도를 유지하였으나 용존산소 농도가 낮은 지하수가 지속적으로 유입되어 용존산소 농도가 낮아지는 것을 관찰했다.
상향류 실험에서 전기전도도의 변화와 용존 고형물의 변화는 대수층의 높은 투수계수로 인해 이류가 우점적으로 발생하여 짧은 시간에 유입 지하수와 유사한 농도를 나타내었다. 반면, 퇴적물부터 지표수 경계면까지는 퇴적물의 낮은 투수계수로 인해 분산(dispersion)이 우점적 이동 기작이며, EC와 TDS가 비교적 낮은 속도로 변화하였으나 유입 지하수의 파과로 인해 컬럼 전체에서 유사한 농도의 값을 나타냈다.
3.2.2 상향류 혼합대의 질소 거동
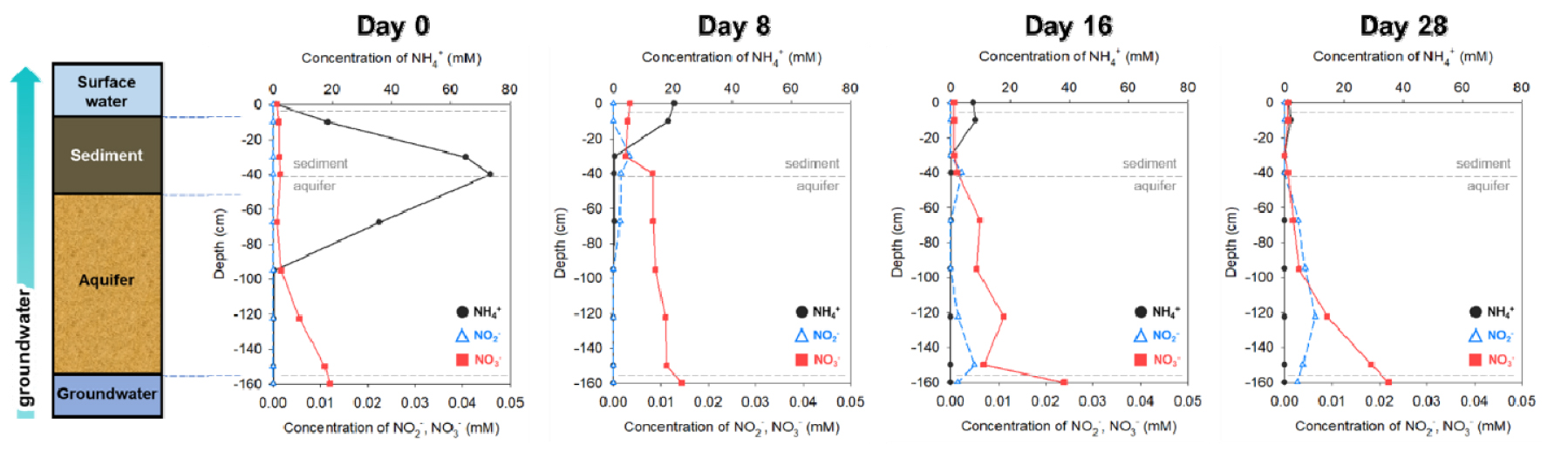
상향류 혼합대 모사 실험 결과를 시간(0, 8, 16, 28 d)에 따라 질소계 화합물의 농도 profile로 나타내었다(Fig. 5). 초기에 퇴적물에 다량 존재하던 NH4+가 지하수의 상향류 흐름에 따라 이류와 분산에 의해 지표수로 이송되는 것으로 판단된다. 대수층에서 NO3-의 경우 증감을 반복하고, NO2-는 대수층의 중하단에 점차 축적되었다.
지하수가 대수층을 통과하며 NO3-가 저감하는 것은 지표수 대비 소량의 염분과 용존산소를 포함하고 있는 지하수가 대수층으로 흐르며, 낮은 농도의 염분에서 증식하는 내염성 탈질미생물에 의해 NO2-로 변환되었기 때문으로 판단된다. 기존의 연구에 따르면 대수층 중하단의 NO2-의 축적은 NO3-가 NO2-로 변환되는 효소에 비해 NO2-가 N2로 변환되는 탈질 미생물의 효소가 염분에 더 크게 영향을 받아 NO2-의 탈질이 더욱 저해된다(Cui et al. 2006, Wan et al. 2014, Kim and Ahn 2019).
본 연구결과에서도 NO3-가 N2로 변환되는 탈질 과정에서 염분에 의한 저해로 인해 중간 생성물인 NO2-가 축적되는 부분 탈질(partial denitrification)이 발생하여 나타나는 유사한 현상이 관측되었다.
지하수의 흐름에 따라 대수층을 통과한 NO2-와 NO3-가 퇴적물에서 급격히 감소하는 것은 퇴적물에서의 낮은 투과성이 체류시간을 길게 유지시켜 비생물학적으로 퇴적물로 질소계 화합물이 흡착하거나 생물학적으로 질산화/탈질이 충분히 발생하며 나타난 현상으로 판단된다(Gomez-Velez et al. 2014). 이를 통해 지하수가 상향류로 흐름에 따라 질소계 오염물질이 퇴적물을 통과하며 흡착 등의 물리화학적 반응과 미생물 매개의 산화와 환원 등을 통한 생물학적 과정에 의해 저감되는 것으로 확인되었다.
상향류 혼합대 구간별 질소 거동을 명확히 비교하고자 퇴적물 상단과 대수층 하단의 시간에 따른 NH4+, NO2-, NO3- 농도 변화를 각각 Fig. 6에 나타내었다. 퇴적물 상단에서는 14일 이후 NH4+가 점차 감소되고, NO3-가 소량 존재하는 것으로부터 질산화가 발생한다고 판단된다. 또한 대수층에서는 14일 이후 NO3-의 증감이 반복되고, NO2-가 지속적으로 축적되는 것으로부터 낮은 용존산소와 저농도의 염분에 의해 부분 탈질이 일어나는 것을 확인했다. 14일 이후 미생물의 활동이 이전보다 활발해진 것은 미생물의 적응(acclimation)과 질산화 및 탈질 미생물의 활동에 적정 pH인 7 – 8에 근접해졌기 때문으로 판단된다.
3.3 하향류 흐름에 따른 혼합대 내 수질 변화
3.3.1 이화학적 지표 농도 변화
혼합대의 상향류와 하향류 등 유체의 혼합과 교차적인 흐름에 따라 pH, ORP, DO가 유의한 농도 차이가 보고된 기존연구 결과(Franken et al. 2001)와 일치하게 하향류의 이화학적 수질 변화 결과는 상향류와 상이하게 관측되었다(Fig. 7). pH의 경우, 지표수가 하향류로 흐르며 퇴적물과 대수층 내 초기 pH 5에서 pH 6 - 7로 미생물의 활동에 적절한 pH 농도로 변화하였다. ORP도 마찬가지로 지표수의 하향류 흐름에 따라 값이 점점 낮아지며 퇴적물의 경우 지표수와 유사하게 변화하며 환원조건을 형성하였다.
지하수 대비 지표수의 높은 용존산소 농도로 인해 지표수가 하향류로 퇴적물 및 대수층에 침투하여 점차 용존산소가 증가하는 것을 확인하였으며, 상향류의 낮은 용존산소 농도(2 mg/L 이하) 대비 하향류 실험 종료 시에는 7 mg/L 이상의 높은 용존산소 농도로 컬럼 전구간이 포화되어 있는 것을 확인하였다. 용존산소 농도의 경우 미생물의 호흡과 산화-환원 상태를 제어하는 주요 인자로 작용하여(Beaulieu et al. 2011), 용존산소가 포화에 가까운 지표수와 용존산소가 비교적 낮은 지하수의 흐름 교환이 발생하는 혼합대에서의 산소 흐름은 산화 과정의 정도를 결정하기 때문에 중요한 요소로 보고되고 있다(Reeder et al. 2018). 따라서 본 연구에서는 지표수의 하향류 흐름에 따른 용존산소의 공급이 지속되며 용존산소와 염분의 지속적인 공급에 따라 질소의 거동 기작이 변화하였을 것으로 판단하였다.
하향류 실험에서의 전기전도도 및 용존고형물의 변화는 퇴적물과 대수층의 전 구간에서 이류가 지배적인 이동 기작임을 확인하였으며, 시간의 흐름에 따라 모든 구간에서 지표수의 전기전도도와 용존고형물 농도와 유사하게 변화하였다.
3.3.2 하향류 혼합대의 질소 거동
하향류 혼합대 모사 실험 결과를 시간(0, 8, 14, 30 d)에 따라 질소계 화합물 농도 profile로 나타내었다(Fig. 8). 호소에서 상향류와 하향류의 흐름 변화에 따라 질소의 농도가 크게 바뀌고 수체의 혼합이 퇴적물과 지표수 경계면에만 국한되는 것이 아니라 더 깊은 대수층까지 확장되어 지하수에도 영향을 미친다는 기존 결과(Krause et al. 2013)와 유사하게 퇴적물에 잔류하던 NH4+가 지표수의 하향류 흐름에 따라 대수층으로 이송되어 대수층까지 지표수가 침투하여 영향을 준 것을 확인할 수 있다.
지표수 하향류 흐름으로 대수층의 NH4+가 증가함에 따라 NO2-와 NO3-가 증감을 반복하고, 실험 30일 이후에는 NH4+, NO2- 및 NO3-가 전 구간에서 저감된 것으로부터 퇴적물과 대수층에서 비교적 높은 용존산소 농도의 지표수가 하향류로 흐르며 생지화학적 질산화가 발생한다고 판단된다. 이러한 질소계 오염물질의 저감요인은 질소계 오염원 농도가 낮은 지표수의 이류로 인해 질소계 오염물질이 컬럼 밖으로 유출되어 최종적으로 유입된 지표수의 질소계 오염물질의 농도와 유사한 경향을 나타낸다. 또한 공극 내 잔류하는 NO3-는 높은 염분 농도의 지표수가 지속적으로 퇴적물과 대수층으로 흐르며, 호염성 질산화 미생물이 증식하고 높은 용존산소로 인해 활발히 활동하며 감소한 것으로 판단된다.
하향류 혼합대의 퇴적물과 대수층 대표지점의 시간에 따른 NH4+, NO2-, NO3- 농도 변화를 각각 Fig. 9에 나타내었다. 퇴적물의 경우 NH4+의 감소 이후 NO2-의 증가 및 감소, NO3-의 증가 및 감소가 순차적으로 발생하는 것으로부터 질산화가 진행되는 것을 확인하였다. 대수층에서도 마찬가지로 퇴적물로부터 지표수와 함께 NO3-가 침투되고, NO2-의 증가와 감소 및 NO3-의 증감이 순차적으로 발생하여 질산화가 발생했다고 판단하였다. 이를 통해 지표수가 하향류로 침투함에 따라 퇴적물과 대수층에 용존산소 및 NH4+ 농도 등에 영향을 주며, 비교적 넓은 범위의 혼합대에서 질산화를 유발하는 것을 확인하였다. 또한 염분 농도 증가에 따른 미생물의 활동 억제보다 용존산소 공급에 따른 미생물의 활성도 증가가 더욱 주요 인자로 작용하는 것으로 확인되었다.
4. 결 론
본 연구에서는 염분의 영향을 받는 혼합대의 지표수와 지하수 흐름 방향에 따른 질소의 거동을 분석하기 위하여 pilot scale의 컬럼에 현장 퇴적물, 대수층 충진재, 지표수, 지하수를 충전하고 혼합대 모사 실험을 진행하였다.
지하수가 지표수로 용출하는 상향류 실험 결과, 낮은 DO 농도의 지하수가 통과한 대수층과 퇴적물의 DO 농도가 비교적 낮게(≤2 mg/L) 유지되었다. 초기 퇴적물에 다량 존재하던 NH4+는 지하수의 흐름에 따라 이류와 분산을 통해 지표수로 이송되었다. 상향류 혼합대의 대수층에서는 염분에 의해 탈질이 억제되어 기존 연구 결과와 일치하게 중간 생성물인 NO2-가 축적되는 부분 탈질이 발생하는 것으로 확인되었다. 또한 지하수의 흐름에 따라 대수층을 통과한 NO2-, NO3-의 농도가 퇴적물에서 급격히 감소하였으며, 이는 퇴적물에서 낮은 투수성으로 인해 체류시간이 길어지며 비생물학적 흡착, 생물학적 질산화 및 탈질이 충분히 발생하며 나타난 현상으로 판단된다.
지표수가 지하수로 유출되는 하향류 실험 결과, 지표수의 높은 DO 농도에 의해 퇴적물과 대수층의 DO 농도가 비교적 높게 유지되었다. 지하수와 지표수의 수체 혼합이 대수층까지 확장되어 지하수에도 영향을 미친다는 기존 결과와 유사하게 퇴적물에 고농도로 잔류하던 NH4+가 지표수의 하향류 흐름에 따라 대수층으로 흘러 지하수로 이송되었다. 하향류 혼합대 퇴적물과 대수층은 지표수에 의해 비교적 높은 DO 농도를 유지하며, NH4+, NO2-, NO3-가 순차적으로 증가 및 감소하며 생지화학적 질산화가 발생하였다. 이는 염분 농도가 높은 지표수가 하향류로 흐르며 흐르며 내염성 질산화 미생물이 퇴적물 및 대수층에 증식하여 나타난 결과로 판단된다.
종합적으로 검토하였을 때, 혼합대의 지표수 및 지하수 흐름에 따라 다양한 기작에 의해 질소계 오염물질이 저감되는 것을 확인하였다. 또한 기수호 내 염분 농도가 미생물 활동 영향인자로 질소 거동에 일부 영향을 미치나 pH, DO, 기질 및 유기물질 농도 등의 다양한 요인이 복합적으로 상호작용하여 질소계 오염물질의 거동에 영향을 미치는 것으로 판단된다.