1. 서 론
2. 재료 및 방법
2.1 M. aeruginosa 배양방법
2.2 초음파 발생장치
2.3 초음파 활용 M. aeruginosa 성장 억제 실험
2.4 분석방법
3. 결과 및 고찰
3.1 시료별 색도와 부유성 변화
3.2 Chlorophyll-a와 M. aeruginosa 개체수의 변화
3.3 성장률과 일차분해율 분석
3.4 M. aeruginosa의 세포 표면 및 내부 형질 변화
3.5 Microcystin-LR 분석
4. 결 론
1. 서 론
최근 기후변화에 따른 수온의 상승 수계 내 설치된 구조물로 인한 하천의 정체수역 발생 및 오염물질의 유입으로 인한 영양염류인 질소 (N), 인 (P)의 수계 내 증가 등 복합적인 요인에 의해 수중 조류 (algae)의 과다증식에 따른 녹조현상 (algal bloom) 발생 빈도가 증가하고 있다 (Kim et al. 2019, Lee et al. 2019, Lee et al. 2020). 이러한 녹조현상으로 chl-a 농도와 M. aeruginosa 개체수 변화, 성장률과 일차분해율을 종합적으로 비교한 결과, 저주파에서 조류 성장 억제 효과가 우수한 것으로 확인되었으며, 저주파에서 M. aeruginosa 세포막으로 에너지 투과 효율이 우수해 기낭 등 내부기관에 더 큰 손상을 유도하기 때문인 것으로 사료된다. SEM과 TEM image 관측을 통해서도 고주파 보다 저주파에서의 M. aeruginosa의 세포 표면 및 세포막의 손상이 명확하게 관측되었다. 마지막으로 초음파에 의한 M. aeruginosa의 기낭 파괴 및 세포막의 기능 손상을 통해 용출되는 독성물질인 microcystin-LR의 수중 유출은 검출한계 (0.1 μg L-1) 미만으로 용출되어 수생태계에 미치는 유해성은 미미한 것으로 판단된다. 핵심어: 조류, 기낭, 성장억제, 저주파, Microcystis aeruginosa, 초음파 인하여 수계의 탁도 증가, 이취미 유발, 수계 내 독성물질 검출, 수생태계 위해성 유발 등의 문제를 야기시켜 (Griffith and Gobler 2020, Joo et al. 2020), 녹조현상의 지속적인 사회적 문제가 되고 있다. 환경부에서는 녹조현상을 유발시키며 독성물질 배출 우려가 있는 유해남조류 (Cyanobacterial Harmful Algal Blooms, CyanoHABs) 중 4종 (Microcystis, Anabaena, Aphanizomenon, Oscillatoria)을 관리대상으로 지정하여 중점적으로 관리하고 먹는 물과 친수용 원수에서의 조류의 발생을 모니터링하여 조류경보제, 수질예보제 등에 이용하고 물환경정보시스템에서 보고하고 있다 (Ministry of Environment 2016). 특히 유해남조류 (CyanoHABs)는 Microcystins, Anatoxin, Saxitoxins 등의 독성물질을 생성하며 (Carmichael 1992, Lee et al. 2003, Codd et al. 2005), 엽록소를 합성하는 과정에서 물의 흙냄새와 곰팡이 냄새의 원인물질인 지오스민 (geosmin)과 메틸이소보르네올 (2-MIB)을 생성한다 (Song et al. 2007). 이러한 녹조현상을 유발하는 유해남조류 중 Microcystis aeruginosa (M. aeruginosa)가 주요한 원인종으로 알려져있으며 (Ma et al. 2005, Paerl and Otten 2013), 이를 예방하기 위해 M. aeruginosa의 성장 억제 및 제어 방안에 대한 다양한 기술이 연구되어지고 있다 (Dittmann and Wiegand 2006, Byeon et al. 2016).
녹조저감기술은 원리에 따라 녹조 발생 전 혹은 초기에 녹조현상 예방을 목적으로 사용되는 물리적 (physical) 제어, 응집제를 활용한 조류저감기술 등의 화학적 (chemical) 제어, 조류 증식에 필요한 영양염류에 대한 경쟁 기술 및 먹이사슬을 통해 조류 섭식을 제거하는 생물학적 (biological) 제어 그리고 각 기법의 장점을 융합하여 다양한 조합으로 이용하는 복합적 (complex) 제어 기법으로 분류된다 (Dittmann and Wiegand 2006, Byeon et al. 2016). 하지만 대부분의 제어공법은 일시적 효과는 보이나 장기간 지속되지 않는다는 단점이 있어 지속가능한 조류 발생 예방 및 억제 방안이 필요한 실정이다.
최근 연구되는 초음파 (ultrasonic)를 이용한 물리적 제어 기법은 초음파가 조류의 기낭 (gas vesicles)을 파괴하여 부력 능력을 상실시켜 조류의 수직운동을 방해해 호소 바닥으로 가라앉게 하고, 이로 인하여 조류의 광합성을 차단하여 조류 성장을 억제한다 (Jachlewski et al. 2013, Park et al. 2013, Purcell et al. 2013, Kong et al. 2019). 초음파 활용 기법은 화학약품의 수체 내 주입 없이 조류 발생 및 성장을 억제하고 조류 세포에 직접적인 손상을 미치지 않아 독성물질의 용출로 인한 수생태계의 위해성이 낮은 환경 친화적인 방법이며, 초음파의 주파수 (frequency), 출력 (watt), 조사시간 (irradiation time)을 조절하여 유해조류의 선택적 성장 억제가 가능하다 (Table 1 참조). 또한 초음파는 유해남조류가 생성하는 독성물질 중 가장 독성이 강한 microcystin-LR을 단기간에 분해시킨다고 알려져있다 (Song et al. 2005, Hudder et al. 2007, Sivonen 2009, Ame et al. 2010, Chen et al. 2020).
기존 선행 연구에 따르면 Zhang et al. (2006)은 고주파, 고출력의 초음파가 M. aeruginosa의 제거를 가속화하는데 가장 효과적인 것으로 실내 실험을 통해 관측하였으며, Wu et al. (2012)은 M. aeruginosa의 성장 억제에 효과적인 초음파의 주파수는 20 kHz>580 kHz>1146 kHz으로 주파수가 낮을수록 조류 성장 억제 효율이 우수하다는 상반된 결과를 보고하였고, Park et al. (2013)의 경우 50 kHz와 70 kHz에서 chlorophyll-a (chl-a)의 높은 저감 효율을 확인하였다 (Table 1 참조). 초음파 활용 조류 성장 억제 관련 선행연구를 종합적으로 고찰한 논문에서는 성장 억제를 위한 목표 조류종별 최적의 초음파 조사조건이 종별로 다르다는 것을 확인할 수 있었다 (Dehghani 2016, Park et al. 2017). 그러나 이러한 대부분의 선행 연구들은 주로 1 L 미만의 작은 부피의 반응조를 활용하여 단기간의 초음파 조사에 따른 조류 성장 억제 실험을 진행한 것으로, 조류 성장 억제의 일시적인 효과는 확인하였지만, 대용량 및 조류 성장억제의 지속성을 확인하기 위한 최적화된 초음파 조사조건을 도출하지 못한 한계가 있었다.
따라서 본 연구에서는 대용량 (7.2 L)의 유해조류 시료를 활용하여, 실험실 규모 (lab-scale) 실험에서 초음파의 고주파, 저주파 조사를 통해 M. aeruginosa의 성장 억제 효과를 조사하였다. 효과 검증을 위해 (1) chlorophyll-a 및 M. aeruginosa의 개체수 변화, (2) M. aeruginosa의 성장률 및 일차분해율, (3) 주사전자현미경 및 투과전자현미경 분석을 통한 M. aeruginosa의 세포 표면 및 내부 형질 변화, (4) microcystin-LR 분석을 통한 독성물질의 수체 내 용출 여부 등을 분석하였다. 그리고 이러한 연구결과를 종합하여 대용량의 시료를 활용한 실내 실험에서 최적의 초음파 조사조건을 도출하였으며, 조류 성장 억제 효율과 효율과의 지속성을 확인하고 현장적용을 위한 가능성을 검증하고자 하였다.
Table 1.
Summary of the ultrasonic sonication conditions and growth inhibition results from previous study for algal growth inhibition
| References | Target species |
Initial cell concentration (cells mL-1) |
Frequency (kHz) |
Power (Watt) |
Irradiation time |
Reactor volume (L) |
Growth inhibition efficiency |
| Hao et al. (2004) | Spirulina platensis | N.A.1 | 20, 200, 1700 | 40 | 5 min | 0.8 |
• 200 kHz > 1.7 MHz > 20 kHz |
| Sim et al. (2006) | Melosira sp. | 500, 1000, 1700 | 28, 40 | 100 - 300 | 20 min | 1 |
• Proportional to ultrasonic power and irradiation time |
| Synedra sp. | |||||||
| Zhang et al. (2006) | Microcystis aeruginosa | 1.5×108 |
20, 80, 150, 410, 690, 1320 | 32, 48, 80 | 5 min | 0.2 |
• Proportional to ultrasonic power and frequency |
| Rajasekhar et al. (2012) | Microcystis aeruginosa | 2×106 | 20 |
9, 17, 28, 87, 64 |
5, 10, 15, 20 min | 0.2 |
• A. circinalis > M. aeruginosa > Chorella sp. |
| Anabaena circinalis | 9.7×105 | ||||||
| Chorella sp. | 2×106 | ||||||
| Srisuksomwong et al. (2012) | Microcystis aeruginosa, Microcystis wesenbergii | N.A.1 | 200 | 3 |
0, 1, 2, 4, 10 min | 0.05 |
• Microcystis wesenbergii > M. aeruginosa • Ultrasonic irradiation time : 2-10 min |
| Wu et al. (2012) | Microcystis aeruginosa | 6×106 | 20 | 8.06 | 30 min | 0.2 |
• 20 kHz > 580 kHz > 1,146 kHz |
| 580 | 0.82 | ||||||
| 1146 | 0.36 | ||||||
| Fan et al. (2013) | Chlorella pyrenoidosa | 107 |
20, 40, 80, 100, 120, 150 | 80 | 5 min | 0.8 |
• Optimal conditions : 80 kHz, 80 W, 5 minutes |
| Park et al. (2013) | Microcystis aeruginosa | N.A.1 |
45, 50, 70, 90 | 1.2 | 5 hr | 20 |
• Optimal conditions : 50 and 70 kHz |
| Purcell et al. (2013) | Microcystis aeruginosa | 4 - 6×106 | 20 | 600 |
5 - 500 sec (Add 1 hr at 862 kHz) | 1.5 |
• Optimal conditions : high frequencies |
| Aphanizomenonflos - aquae | |||||||
| Scenedesmus subspicatus | 582, 862, 1144 | 200 |
• Optimal conditions : low frequencies | ||||
| Melosira | |||||||
| Rodriguez-Molares et al. (2014) | Microcystis aeruginosa | 13.3×106 | 21.5 | 8.24 | 10 min | 0.6 |
• Sedimentation rate : 50% within 24 hours • Sedimentation continued for the next 7 days |
| Yamamoto et al. (2015) | Chlamydomonas concordia | 1×107 |
20, 580, 864, 1146 | ~3, ~20, ~60 | 30 min | 0.4 |
•C. concordia : 20 < 580 < 864 < 1146 kHz • D. salina : 20 < 580 ≅ 864 < 1146 kHz |
| Dunaliella salina | |||||||
| Lee et al. (2018) | Microcystis sp. |
8 - 25×103, 4 - 8×104 | 20 | 150 |
0, 20, 40, 80, 100, 150, 200, 400, 600 sec | 0.3 |
• Microcystis sp. removal efficiency at the high initial concentration was greater |
2. 재료 및 방법
2.1 M. aeruginosa 배양방법
본 실험에서 사용된 남조류 M. aeruginosa는 W 저수지로부터 채수하여 실험실에서 동정분리하였다. 모든 배양실험은 표면적 182.5 cm2, 부피 500 mL의 Cell Culture 플라스크 (VWR, Co., America)에 pH 9로 조정한 CB배지와 일정량의 M. aeruginosa를 접종하여 배양하였다. 배양조건은 27 ± 1°C, 12 μmol-photons m2 s-1, 1일 간격으로 명암주기 (12시간 light/dark cycle)가 자동 조절되는 진탕배양기에서 28 ± 1 rpm으로 18일간 배양하여 실험에 사용하였다. M. aeruginosa의 배양에 사용된 CB 배지의 구체적인 조성은 Table 2에 제시하였다. (NIER 2007)
Table 2.
Composition and injected amount of component per liter of CB media used for cultivation of M. aeruginosa. (pH 9.0 ± 0.1)
2.2 초음파 발생장치
초음파 조사가 M. aeruginosa에 미치는 영향을 파악하기 위하여 초음파 발생장치와 진동판 구동회로를 직접 조합하여 제작하였다 (AD Sonic, Co., Korea). 본 실험의 초음파 발생장치의 진동판은 23 kHz의 경우 Hainertec Co. (China)의 상용화된 제품이며 진동판 면적이 19.6 cm2인 제품을 활용하였다. 1.6 MHz의 경우 AD Sonic Co. (Korea)에서 제작한 초음파 가습기 진동판을 활용하였으며 진동판 면적은 2.5 cm2으로 제작하여 실험에 적용하였다.
2.3 초음파 활용 M. aeruginosa 성장 억제 실험
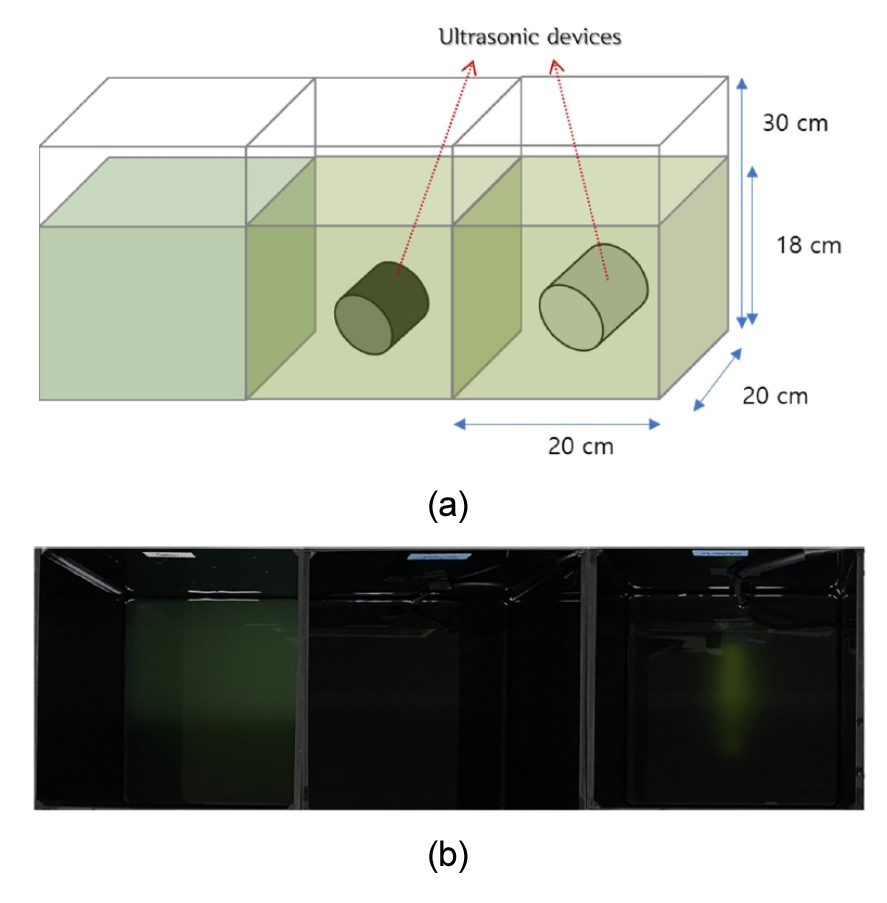
초음파의 조사조건이 M. aeruginosa의 성장에 미치는 영향을 비교·분석하기 위해 A: 대조군 (Control), B: 실험군 (주파수 1.6 MHz, 출력 1.38 W L-1), C: 실험군 (주파수 23 kHz, 출력 4.17 W L-1)의 조건을 적용하였다. 기존 연구에서 M. aeruginosa의 초기 개체수가 높은 시료에서 조류의 성장억제 효과가 나타난 것으로 보고되어 (Lee et al. 2018), 본 실험에서는 조류경보제 발령기준 중 조류대발생 남조류세포수 농도 1×106 cells mL-1보다 높은 4.6×106 cells mL-1로 초기 농도를 적용하였다. 기존 대부분의 연구에서 비교적 적은 용량 (<1.5 L)의 남조류 시료를 대상으로 조류 성장 억제 실험을 진행한 반면 본 연구에서는 대용량 7.2 L로 실험하였다. 또한 Table 1에 제시되었듯 기존 연구에서 초음파 조사 시간이 수 분에서 5시간으로 조사된 반면 본 연구에서는 대용량의 시료를 고려하여 6시간 동안 조사 하였다. 모든 실험은 차광된 아크릴 반응조 (acrylic reactor, W 20 cm × L 20 cm × H 30 cm)에서 진행되었으며 (Fig. 1 참조), 정량화된 실험값을 위해 반응조 내 시료의 충분한 교반 후 시료를 채취하여 일정 침전시간 이후 상등액을 취수하여 chl-a 및 개체수 측정을 진행하였다.
2.4 분석방법
2.4.1 M. aeruginosa 개체수 분석
초음파 조사에 따른 M. aeruginosa의 성장억제 효과를 관찰하기 위해 셀 개체수 분석을 진행하였다. 시료 채취 직후 루골 (lugol)용액을 이용해 셀을 고정한 후 암실 보관하였으며 혈구계수기 (Marienfeld, Germany)와 광학현미경 (DN-10A, Samwon Scientific Industries, Ltd., Korea)을 이용하여 개체수를 관찰하였다. 또한 시간에 따른 개체수의 변화율을 아래 Eqs. 1 and 2를 적용하여 M. aeruginosa의 성장률 (growth rate)과 일차분해속도 (first order decay)를 도출하였다.
μ는 비성장속도상수 (hr-1), k는 일차분해속도상수 (hr-1), N0 및 Nt는 실험 초기와 일정시간 경과 후의 M. aeruginosa의 개체수 (cells mL-1), t는 경과시간 (hr)을 나타낸다.
2.4.2 M. aeruginosa의 세포 표면 및 내부 형질 분석
초음파 조사에 따른 M. aeruginosa의 표면 및 내부 기관의 손상을 관측하기 위해 주사전자현미경 (scanning electron microscopy, SEM)과 투과전자현미경 (transmission electron microscopy, TEM)을 통해 분석하였다. SEM 분석을 위해 남조류 시료를 falcon conical tube에 10 mL 채취해 동결건조기 (FDCF-12012, OPERON, Co., Korea)를 이용해 온도 -80°C, 압력 80 mmHg으로 적용하여 48시간 동안 동결건조를 진행하였다. 건조된 시료는 lon coater (HC-21, Hyo Yeon Tech, Co., Korea)를 이용하여 백금 (Pt) 코팅을 진행하였으며, 코팅 두께는 약 10 nm로 적용하였다. 코팅 후 FE-SEM (field emission scanning electron microscope)인 MAIA3 (TESCAN, Czech)를 사용하여 10 kV의 가속전압에서 M. aeruginosa의 세포 표면을 관찰하였다.
TEM 분석을 위해 남조류 시료를 0.5 mL 채취해 2% glutaraldehyde와 0.05 M cacodylate buffer (pH 7.2)로 완충시킨 2% glutaraldehyde 용액을 포함하여 10 mL로 4시간 동안 고정한 후 고정액을 제거한 다음 0.05 M cacodylate buffer로 세정하였다. 세정 후 0.05 M cacodylate buffer로 완충시킨 2% OsO4로 1시간 동안 추가 고정 후 0.05 M cacodylate buffer로 추가 세정하였다. 그 후 30%, 50%, 70%, 90%, 95%, 100% (2회) ethyl alcohol로 탈수하여 100% ethyl alcohol와 LR White resin을 2:1, 1:1, 1:2로 혼합한 용액을 6시간 간격으로 치환하여 침투시켰으며, 100% LR White resin으로 2회 치환 후 gelatin capsules에 시료와 LR White resin 용액을 넣고 밀봉하여 60°C 오븐에서 24시간 경화시켰다. 경화된 시료는 ultramicrotome에 유리 나이프를 장착해 TEM 관찰할 범위를 결정 후 다이아몬드 나이프를 이용하여 80 – 100 μm 두께로 절편을 제작하였고 제작된 절편은 nickel grid 위에 고정한 후 4% uranyl acetate와 0.4% lead citrate를 이용해 이중염색하였다. 전처리 과정을 거쳐 염색된 시료는 건조 후 FE-TEM (field emission transmission electron microscope)인 JEM-2100F (JEIL, Ltd., Japan)를 이용하여 200 kV 가속전압에서 M. aeruginosa의 내부단면을 관찰하였다.
2.4.3 시료 중 microcystin-LR 농도 분석
초음파 조사에 따른 M. aeruginosa의 독성물질 유출을 확인하기 위해 microcystin-LR 분석을 실시하였다. 일정량의 시료 내 조체를 분석용 초음파분쇄기를 통해 파쇄하여 직경 47 mm, 공극 1.2 μm의 GF/C 여과지로 여과하였으며, 여과된 시료 100 mL를 취하여 gramicidin-S를 메탄올에 용해시킨 내부표준물질 용액 (1 mg L-1)을 정확히 40 μL 취해 시료에 첨가하였다. 또한 고상 카트리지 (C18, SPE, FUTECS, Co., Korea)를 활성화시키기 위해 메탄올 10 mL를 흘려준 후 정제수 10 mL를 흘려 메탄올이 완전히 제거되도록 하였으며, 활성화된 고상 카트리지가 건조되기 전에 준비된 시료를 카트리지에 10 mL min-1 이하의 속도로 흘려주었다. 이후 20% 메탄올 5 mL를 추가로 통과시켜 고상 카트리지의 불순물을 제거하였고, 0.1% TFA (trifluoroacetic acid)/메탄올용액 5 mL를 천천히 통과시켜 고상 카트리지 내에 흡착되어 있는 microcystin을 용출시켰다. 최종 용출용매 5 mL를 진공농축기 또는 질소가스를 이용하여 완전히 건조시켜 건조된 microcystin을 메탄올로 용해해 1,000 μL의 최종액 중 시험용액 100 μL를 취하여 액체크로마토그래피 질량분석기 (LC-MS, Thermo scientific, Co., Korea)에 주입하여 분석하였다.
3. 결과 및 고찰
3.1 시료별 색도와 부유성 변화
초음파 조사 6시간 이후 대조군 (A, Control)과 실험군B, 실험군C의 시료 변화를 19일 동안 육안으로 관찰한 결과, 초음파 조사 전에는 대조군과 실험군 모두에서 M. aeruginosa 특유의 녹색과 부유성이 관찰되었다 (Fig. 2 (a)). 초음파 조사 종료 3일 후 대조군의 경우에는 녹색과 부유성이 지속적으로 유지되었으나 실험군B와 실험군C는 초음파 조사 전 보다 투명해진 것을 확인하였다 (Fig. 2 (b)). 이러한 시료의 변화는 고주파 (B) 보다 저주파 (C)에서 크게 관찰되었다. 초음파 조사 종료 19일 후, 대조군의 경우 이전과 동일하게 녹색과 부유성이 유지되었지만 실험군B와 실험군C의 경우 시료 중 M. aeruginosa의 침전으로 녹색이 거의 사라져 투명해진 것을 확인하였다 (Fig. 2 (c)). 이러한 결과는 초음파가 조류 성장 억제에 효과가 있음을 육안상으로 확인한 것으로, 고주파 조사 조건 (B)에서 보다 저주파 조사 조건 (C)에서 시료의 투명도 증가가 크게 관찰된 것으로 보아 저주파가 고주파 보다 조류 성장 억제에 효과적인 것으로 판단된다.
3.2 Chlorophyll-a와 M. aeruginosa 개체수의 변화
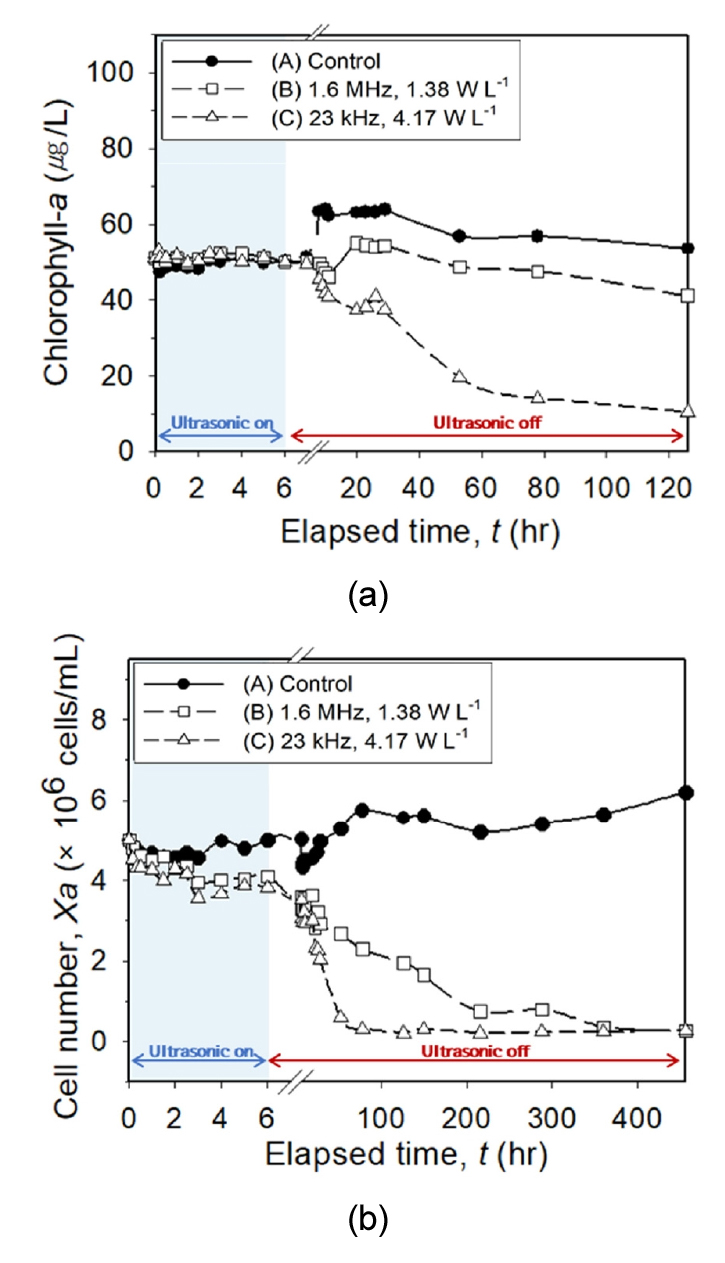
시간 경과에 따른 chl-a와 개체수를 검토한 결과 (Fig. 3 참조), 대조군은 관찰 기간 동안 chl-a 농도와 개체수가 비교적 균일하게 유지되어, 추가적인 조류 성장 억제 요인은 없는 것으로 판단된다. 실험군B는 6시간 초음파 조사에 따른 chl-a 농도가 초음파 조사 이후 5일 동안 큰 변화는 확인되지 않았으나 (Fig. 3 (a)), 5일 이후 19일 동안 (Fig. 3 (b))에는 M. aeruginosa 개체수는 점차 감소하였다. 실험군C의 경우 chl-a 농도 및 M. aeruginosa 개체수가 상대적으로 급격하게 감소하였다. 실험군B는 M. aeruginosa 개체수가 감소하여 15일 이후 90% 이상의 조류 성장 억제 효율이 관측되었으나, 실험군C는 초음파 조사 3일 이후 90% 이상의 조류 성장 억제 효율이 나타났다. 이러한 결과는 고주파 (B) 보다 저주파 (C)에서 조류 성장 억제가 단기간에 더 효과적이라는 것을 보여준다 (Fig. 3).
두개의 실험군에서 모두 초음파 조사 기간 (≤6시간) 동안 chl-a와 M. aeruginosa 개체수의 변화는 미미하게 관측되었으나 초음파 조사 종료 이후부터 chl-a와 개체수가 저감되는 경향이 명확하게 관찰되었다. 이는 초음파 조사 시 보다 초음파 조사 이후 조류 성장 억제 효과가 크다는 것을 보여준다. 기존 선행 연구에서는 초음파 조사 시 즉각적인 조류 성장 억제 효과가 관측되었다고 보고하고 있으나 (Zhang et al. 2006, Srisuksomwong et al. 2012, Rodriguez-Molares et al. 2014), 선행연구의 시료 용량 (<1.5 L) 대비 본 연구의 실험 용량 (7.2 L)의 크기가 약 5배 크고 초기농도도 상대적으로 높은 조건이며, 단위부피당 초음파 에너지도 선행연구 조건 (13.73 - 400 W L-1)에 비해 본 연구 (1.38 W L-1, 4.17 W L-1)가 상대적으로 낮아 조류 성장 억제 속도가 지연되는 것으로 판단된다. 즉, 낮은 초음파 에너지가 높은 조류 개체수에 분산되어 조류 세포막과 내부 기관에 미치는 직접적인 영향이 지연 및 감소되어 즉각적인 조류 성장 억제 효과가 관측되지 않은 것으로 사료된다.
3.3 성장률과 일차분해율 분석
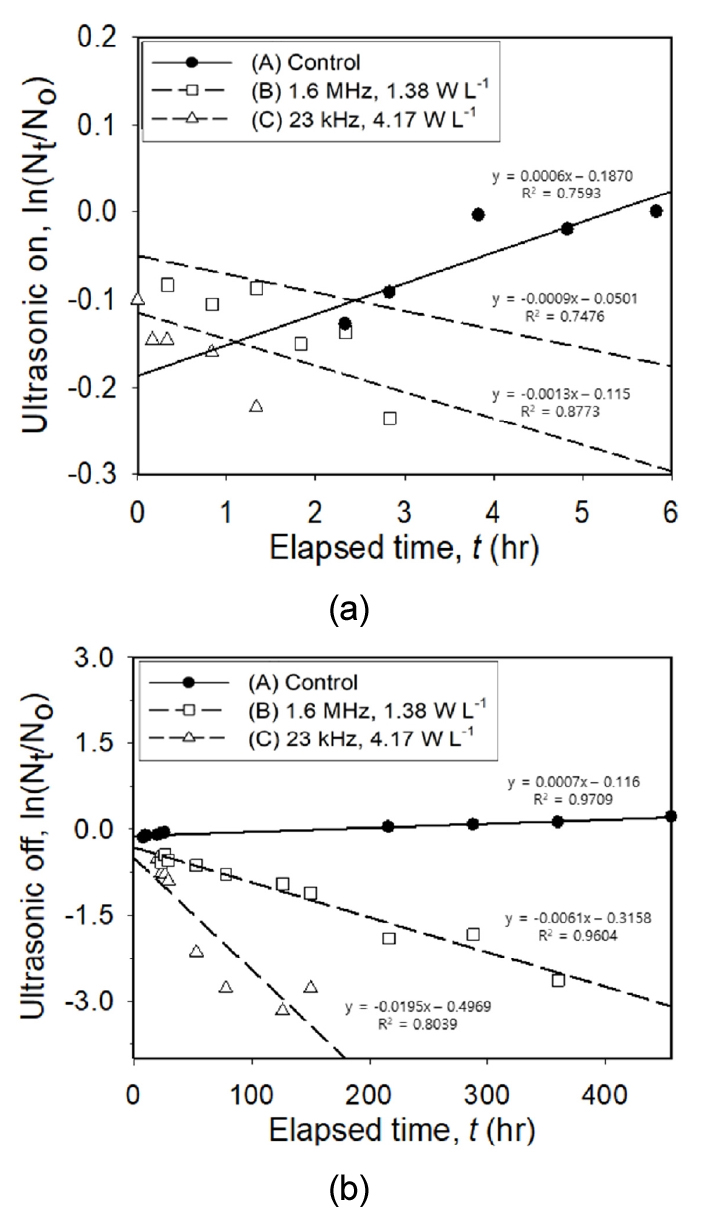
M. aeruginosa의 개체수를 이용해 비성장속도상수 (μ)와 일차분해속도상수 (k)를 도출한 결과, 초음파 조사 기간 동안 (≤6시간) 대조군에서 비성장속도상수가 μ=6 × 10-4 hr-1로 도출되어 조류의 성장을 확인하였으며, 실험군B와 실험군C의 경우 성장률 대비 높은 일차분해율이 관측되었다 (Fig. 4, Table 3). 특히 실험군B (kB, Ultrasonic on=9 × 10-4 hr-1) 보다 실험군C (kC, Ultrasonic on=1.3 × 10-4 hr-1)에서의 높은 일차분해속도상수가 도출되었으나 초음파 조사 기간 동안 두 실험군에서 조류 성장 억제 효율의 유의한 차이는 확인되지 않았다.
초음파 조사 종료 이후에는 대조군에서 비성장속도상수가 μ=7 × 10-4 hr-1로 나타났다 이는 시간 경과에 따른 조류의 성장에 차이가 없고, 관찰기간 동안 추가적인 조류 성장 억제 요인은 없는 것으로 판단된다. 실험군B와 실험군C의 경우에는 대조군 대비 높은 일차분해율이 관측되었으며, 초음파 조사기간 보다 조사 종료 이후의 일차분해율이 크게 나타났다 (Table 3 참조). 초음파 조사 종료 이후 실험군B (kB, Ultrasonic off=6.1 × 10-3 hr-1) 보다 실험군C (kC, Ultrasonic off =1.95 × 10-2 hr-1)에서 약 3배 높은 일차분해상수를 보였으며, 이는 저주파 (C)에서의 조류 성장 억제 효과가 더 우수함을 나타낸다 (Table 3, Fig. 4). 이러한 결과는 Wu et al. (2012), Purcell et al. (2013), Huang et al. (2020) 등 선행연구와 일치하고 있다. 이는 저주파에서 M. aeruginosa 세포막으로 에너지 투과 효율이 우수하여 기낭 등 내부기관에 더 큰 손상을 유도하기 때문인 것으로 사료된다.
Table 3.
Summary of growth rate (μ) and first order decay constant (k) of M. aeruginosa using (A) control, (B) ultrasonication with high frequency (1.6 MHz, 1.38 W L-1) and (C) ultrasonication with low frequency (23 kHz, 4.17 W L-1)
3.4 M. aeruginosa의 세포 표면 및 내부 형질 변화
SEM 분석 결과, 선행연구 결과 (Li et al. 2014, Huang et al. 2020, Peng et al. 2020)와 동일하게 대조군은 세포 표면의 손상이 발견되지 않았으나 실험군B와 실험군C에서는 세포 표면 및 세포막의 손상 (rupture)이 확인되었다 (Table 4 참조). 조사시간이 3시간에서 6시간으로 증가됨에 따라 M. aeruginosa의 세포 표면 및 세포막의 손상이 더 심화된 것을 확인하였으며 고주파 (B)에서 보다 저주파 (C)에서 명확하게 관측되었다.
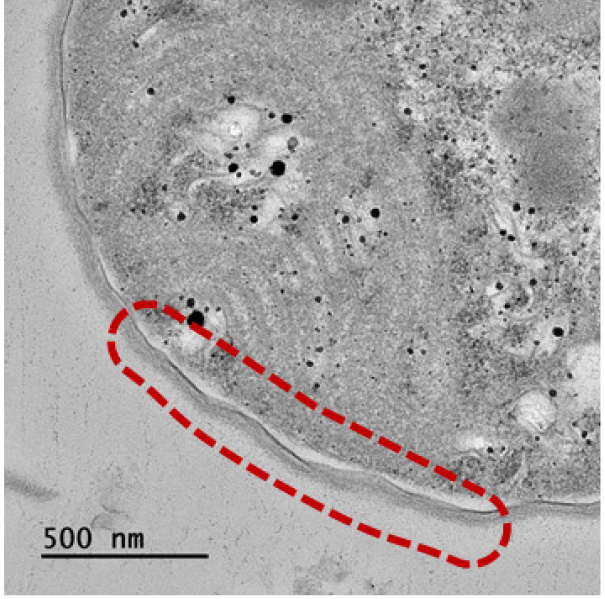
TEM 분석 결과, 대조군과 실험군C의 조건 (23 kHz, 4.17 W L-1)으로 6시간 동안 초음파를 조사한 시료를 비교하였을 때 조류 세포막의 일부 손상이 관측되었다 (Table 5). 하지만 선행연구 결과에서 확인된 초음파에 의한 조류 세포 내 기낭의 파괴 및 분포 감소 (Jachlewski et al. 2013, Park et al. 2013, Purcell et al. 2013, Kong et al. 2019)는 본 연구에서는 명확히 관측되지 않아 추가적인 실험을 통한 검증이 요구된다. 이러한 결과는 선행 연구에 비해 상대적으로 본 연구의 단위부피당 초음파 에너지가 낮고 조류 개체수가 많아 초음파 에너지가 분산되어 조류 기낭 등의 내부 기관에 미치는 직접적인 영향의 지연 및 감소로 인한 것으로 사료된다.
Table 4.
The scanning electron microscopic images of M. aeruginosa. (a) Control (normal cell) after 13 days, (b) 3 hr ultrasonic irradiation (1.6 MHz, 1.38 W L-1), (c) 3 hr ultrasonic irradiation (23 kHz, 4.17 W L-1), (d) 6 hr ultrasonic irradiation (1.6 MHz, 1.38 W L-1), and (e) 6 hr ultrasonic irradiation (23 kHz, 4.17 W L-1). (note that arrows indicate ruptures cell membrane of M. aeruginosa)
| Irradiation time | Control A |
Experiment B (1.6 MHz, 1.38 W L-1) |
Experiment C (23 kHz, 4.17 W L-1) |
| t = 3 hr |  (a) | 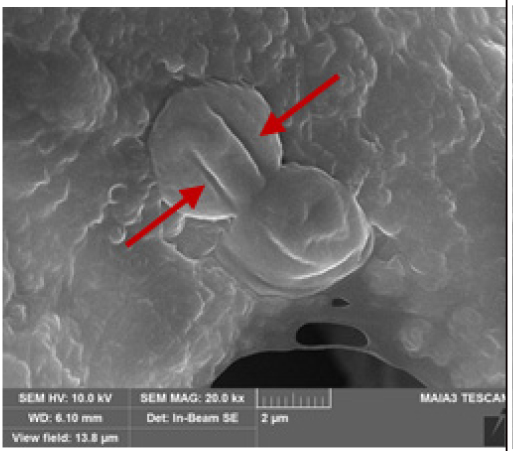 (b) | 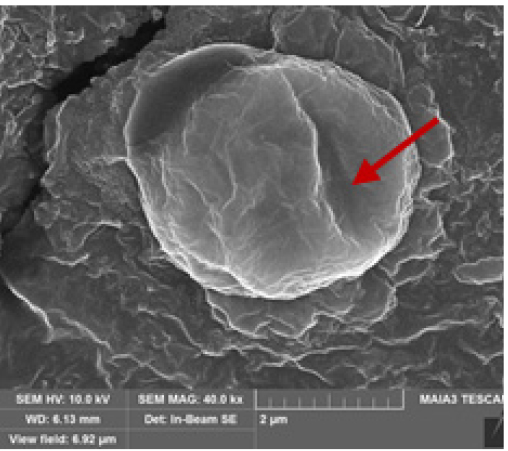 (c) |
| t = 6 hr | 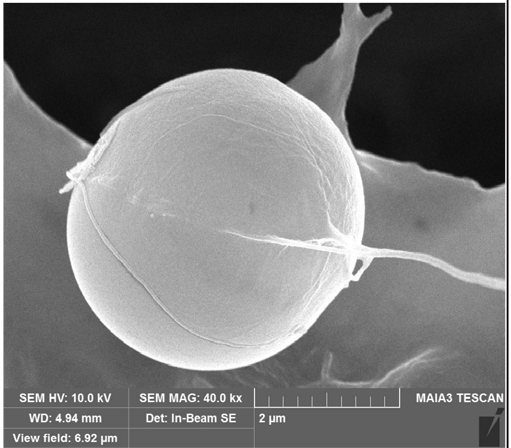 (a) |  (d) |  (e)
(e)
|
Table 5.
The transmission electron microscopy images of M. aeruginosa. (a) Control (normal cell) after 13 days and (b) 6 hr ultrasonic irradiation (23 kHz, 4.17 W L-1). (note that red dotted line indicate damage of M. aeruginosa cell surface and internal organs)
| (a) Control | (b) 23 kHz, 4.17 W L-1 | |
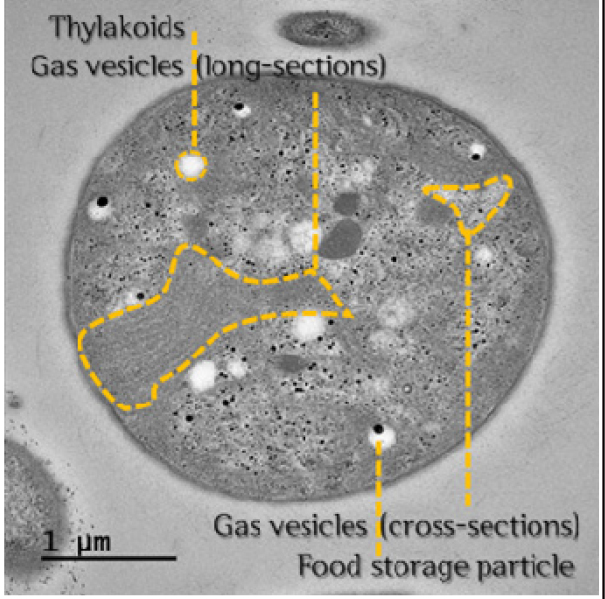 | 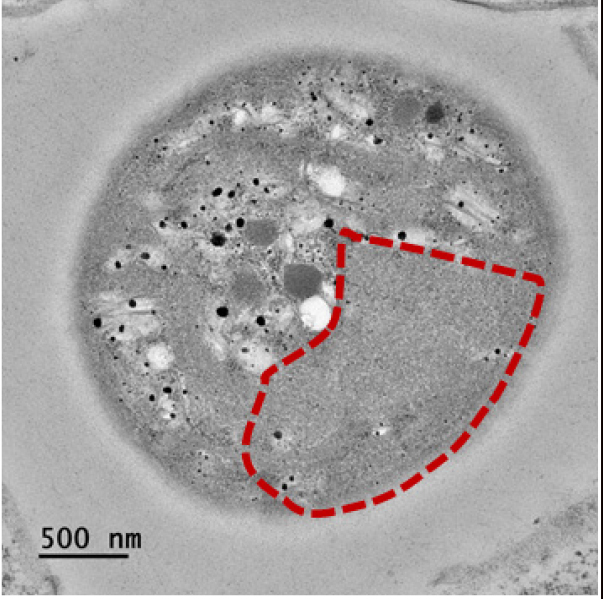 |  |
3.5 Microcystin-LR 분석
초음파에 의한 M. aeruginosa의 기낭 파괴 및 세포막의 기능 손상을 통해 용출되는 독성물질인 microcystin-LR은 대조군과 실험군B, 실험군C 모든 시료에서 검출되지 않았다. 이는 microcystin-LR의 수중 유출이 거의 없거나 검출한계 (0.1 μg L-1) 미만으로 용출된 것, 또는 초음파에 의한 microcystin-LR의 분해 등의 원인으로 파악될 수 있으나 (Song et al. 2005, Hudder et al. 2007, Sivonen 2009, Ame et al. 2010, Chen et al. 2020), 대조군에서 microcystin-LR이 검출되지 않아 그 원인을 정확히 판단하는데 어려움이 있어 추가적인 실험이 요구된다.
4. 결 론
본 연구에서는 수생태계의 위해성이 낮으며 선택적으로 유해남조류의 성장 억제가 가능한 초음파 기법의 현장적용 전 M. aeruginosa의 성장 억제 효과를 실험실규모 실험을 통해 검증하였다. 고주파, 저주파 비교 실험을 통하여 chlorophyll-a, M. aeruginosa 개체수, 비성장속도상수와 일차분해상수, SEM과 TEM, microcystin-LR을 검토하여 최적의 조건을 도출하였다. 본 연구 결과는 다음과 같다.
1) Chl-a와 M. aeruginosa 개체수 분석 결과, 초음파가 효과적으로 조류 성장을 억제함을 확인하였으며, 고주파 (1.6 MHz, 1.38 W L-1)보다 저주파 (23 kHz, 4.17 W L-1)에서 조류 성장 억제 효율이 우수한 것으로 판단되며 초음파 조사기간 보다 조사 종료 이후 조류 성장 억제가 급격히 증가하는 것을 확인하였다.
2) SEM, TEM 분석 결과, 초음파의 조사시간이 길수록 조류 세포 표면 및 세포막의 손상이 명확히 관측되었으며 M. aeruginosa의 기낭 파괴 및 분포의 감소는 명확히 확인되지 않았다.
3) Microcystin-LR 분석 결과, 초음파에 의한 세포 표면 및 세포막의 손상으로 인한 내부의 독성물질이 불검출 혹은 검출한계 (0.1 μg L-1) 미만으로 나타났다.
4) 종합적으로 검토하였을 때, 초음파에 의한 조류 성장 억제 효과를 확인하였으며 고주파 보다 저주파에서 조류 성장 억제 효과가 더 우수한 것으로 판단된다. 본 연구결과를 바탕으로 향후 초음파의 낮은 주파수를 세분화하여 주파수별, 출력별, 조사시간별, 초기 조류 농도별 등 추가 실험을 통해 최적의 초음파 조사조건을 도출할 것이다.