1. 서 론
2. 연구 방법
2.1 화분 실험 방법
2.2 유기산 선정 실험
2.3 유기산 첨가 화분 실험
2.4 분석방법
3. 결과 및 토의
3.1 토양의 물리화학적 특성 및 중금속 분포
3.2 화분실험에서의 식물 생장 및 비소 제거
3.3 유기산 선정
3.4 Oxalate 첨가 화분실험
4. 결 론
1. 서 론
비소(Arsenic, As)는 토양과 암석에 존재하는 미량 원소로 유럽 및 미국 표토의 As 평균농도는 각각 7.0 및 7.2 mg/kg (Stafilov et al. 2010)으로 매우 낮다. 그러나 살충제, 인 함유 비료, 반도체, 광업 및 제련업, 석탄 연소, 목재 방부제 등과 같은 인위적 산업활동에서 환경으로 배출되어 환경을 오염시키고(Mondal et al. 2006), 먹이사슬에 유입되어 인간 건강에 위해를 준다(NIBR 2008). As는 발암물질일 뿐 아니라 심혈관 질환, 다발성신경증(neuropathy) 등도 유발하여 미국 및 캐나다에서는 환경기준을 강화하였다(Kapaj et al. 2006).
국내에서도 장항제련소 연돌에서 배출된 중금속 함유 입자에 의해 주변 토양이 오염되었고(KECO 2008), 오염지역을 중심으로 2 km까지의 매입구역과 반경 2-4 km까지의 비매입구역에서 오염토양을 정화하였는데, 제련소 굴뚝에서 입자상으로 배출된 As가 대부분 광물과 결합된 형태로 생물이용성이 총량의 10%에 불과하기 때문에(Jeong et al. 2011, Yang et al. 2014, Kim et al. 2016), 물리화학적 공법인 토양세척, 토양치환 및 고형화/안정화가 주된 공법으로 적용되었다(Moon et al. 2011).
장항 제련소 인근 해변에 위치한 송림 지역에 대한 위해성평가 결과 송림 일부 지역(1,379 m2)에서 As 농도가 목표발암위해도(1×10-5)를 초과하였는데, 송림을 보전하기 위해 물리화학적 공법을 적용하지 않고 부분적으로 식물재배정화 시범사업을 실시하기로 결정하였다(MOE 2015). 실시설계를 위한 실험결과에 의하면 비소 과축적식물인 큰봉의꼬리(Pteris cretica) 재배에 시더러포어(siderophore) 생산미생물 Pseudomonas aeruginosa를 주입하여 16주간 재배하고, 지상부를 10회 수확하여 제거하면 정화목표를 달성할 수 있는 것으로 보고되었다(MOE 2015). 그러나 큰봉의꼬리는 외래식물로 보호수인 소나무와 송림 내의 자생(native) 식물상에 침입종이 될 수 있고, 고사리순 채취/섭식에 의한 인체 전이에 대한 위해가능성에 대한 의견도 제시되었다.
식물 건조중량(Dry Weight, DW) 1 kg당 1,000 mg-As를 흡수하여 효과적인 식물재배정화가 가능한 As 과축적 식물은 Pteris 속 7종과(Ma et al. 2001, Zhao et al. 2002, Srivastava et al. 2006), 다른 고사리 종인 Pityrogramma calomelanos (Francesconi et al. 2002) 및 쇠비름속 식물 2종인 Portulaca tuberosa Rox와 Portulaca oleracea L.에 불과하며(Tiwari et al. 2008), 외래종 양치식물이거나 양지식물로 현장에 적용할 수 없다. 또한, 대상지역이 산림청 보호종인 송림이 우거져 지표면은 반양지이고, 소나무의 타감작용(allelopathy)도 발생할 수 있는 지역이므로, 현장조건에서 생장할 수 있는 새로운 As 정화 식물종에 대한 연구가 필요하였다.
문헌 조사에서 보고된 식물종 및 해당 식물체 As 농도는 비름속(Amaranthus blitoides S. Watson) 114 mg/kg-DW (Del Rio et al. 2002), 천일홍(Gomphrena globose) 및 백일홍(Zinnia elegans) 100 mg/kg-DW (Signes-Pastor et al. 2015), 루피너스(Lupinus microcarpus) 10 mg/kg-DW (Diaz et al. 2016), 댑싸리(Bassia scoparia) 107 mg/kg-DW (Gisbert et al. 2008) 이었다. 또한 현장식생조사에서 송엽국(Lampranthus spectabilis), 수크령(Pennisetum alopecuroides), 인동덩굴(Lonicera japonica), 명아주(Chenopodium album) 및 맥문동(Liriope muscari)이 송림 및 인근 지역에서 자생하고 있어, 이 식물종에 의한 As 흡수 및 제거 가능성 확인도 필요하다고 판단되었다.
정화식물은 As 독성을 견딜 수 있고 As 흡수능이 높으며 지상부에 비소를 고농도로 축적하지만 먹이사슬에는 편입되지 않는 식물로, 종자/종묘 확보가 경제적으로 가능하고 염해에 강하여 해안 송림에서의 재배와 관리가 쉽고 지피성이 우수하며 현장생태계를 교란하지 않는 식물이 이상적일 것이다. 이에 상기 조건에 적합한 정화식물을 선정하기 위해, 송림과 유사한 조도 조건의 온실에서 화분 실험으로 지상부에 고농도 As를 축적하는 식물을 선정하고, 식물생장상 실험에서 유기산 첨가에 의한 식물의 As 흡수 증진 조건을 연구하였다.
2. 연구 방법
2.1 화분 실험 방법
장항 송림 현장에서 채취한 100 kg의 토양(이하 송림토양)을 실험실에서 체가름하여 유기물 및 식물 잔재물을 제거하고 용량 20 L의 roll mixer로 균일하게 혼합하였다. 지름 10 cm 화분에 0.5 kg의 송림토양과 함께 미리 배양토에서 발아시켜 둔 유식물을 3배수로 정식하였는데, 뿌리 크기가 큰 송엽국, 인동덩굴 및 맥문동은 뿌리를 1/4로 분할하여 정식하였다. 온실은 독립난방장치를 설치하여 20°C로 유지하였고, 온도 모니터링 장치로 온도를 확인하였다. 또한, 온실 상부에 그물망을 씌워 장항 송림 현장과 유사하게 조도를 최고 15,000 Lux 이하로 유지하였다.
식물은 As를 P 전달체로 흡수하기 때문에, P와 As는 식물흡수에 관해 경쟁적 관계에 있다. 특히 사질토에서는 P를 흡착할 수 있는 점토량이 낮아 유효인산으로 존재하는 비율이 높으므로 식물에 의한 As 흡수를 방해한다(Huang et al. 2007). 토양에 P가 부족하면 식물의 As 흡수가 증가할 수 있으나, P는 필수 영양소이므로 액비(바이오가든, N 6%, P 8%, K 5%)를 2000배 희석하여, 각 화분당 2 주에 한 번 50 mL씩 시비하였다. 관수에 의한 As 용출을 방지하기 위해 식물 생장에 맞추어 송림토양의 용수량(Water Holding Capacity, WHC)에 해당하는 양만큼 관수하였다. 온실 실험은 98일간 지속하였다.
2.2 유기산 선정 실험
암소에서 풍건한 장항 토양 4 g을 50 mL 유리병에 넣고, 100 mmol/kg-soil 비율의 유기산 5 mL과 10 mM의 CaCl2 40 mL을 넣은 다음, 20°C에서 200 rpm으로 48시간 교반하였다. 이때 대조군은 유기산 대신 10 mM의 CaCl2 5 mL을 주입하였다. 교반 완료 후, 원심분리기에서 3000 rpm으로 20분간 원심분리하고 상징액을 0.2 mm acetate filter로 여과하여 상징액의 pH와 중금속 농도를 측정하였다. 이때 실험에 사용한 phytate (≥90% phosphorus (P) basis (dry basis)), oxalate (≥98%), citrate (≥99%) 및 succinate (≥99%)는 모두 Sigma-Aldrich Co.에서 구입하였다.
2.3 유기산 첨가 화분 실험
대상 식물종을 송림토양 0.5 kg을 넣은 10 cm 화분에 3배수로 정식한 다음, 온실에서 1개월간 재배하고 생장 상태가 균일하고 활력이 있는 식물 12개체를 선별하여 실험실로 운반하였다. 이 식물들은 WHC 실험 방법과 같이 바이오가든 1/2000 영양액에 담가 포화 시킨 다음 꺼내어 정치하였다. 이후 화분 전체 무게를 측정하고, 식물생장상에서 5일간 매일 무게 감소량을 측정하여 1일 증발산량을 산정하였다. 식물생장상의 환경은 조도 15,000 Lux, 온도 25°C, 습도 60%이며, 낮 16시간 밤 8시간으로 운영하였다.
침출수 회수를 위한 플라스틱 통을 화분 아래에 설치하고 랩으로 밀봉한 화분에 송림토양 0.5 kg을 넣고, 각 식물을 정식한 다음, 식물생장상에서 1개월 간 재배하였다. 유기산은 주입 총량이 0(대조군), 10, 20 및 40 mmol/kg-soil으로 한번에 주입하지 않고 15 혹은 20 회 분할한 다음, 해당 식물의 1일 증발산량에 해당하도록 증류수와 혼합하여 주입하였다. 실험이 종료된 후, 수집한 침출수는 부피를 측정하고 여과한 다음 As 농도를 분석하였다. 식물체는 수확 즉시 잎의 Chl.-a 함량을 측정하고, 식물체를 회수하여 증류수로 깨끗이 세척한 다음 지상부와 지하부의 생체량과 건조중량을 측정하였다. 토양은 균일하게 혼합하고 일부 시료를 채취하여 DHA (dehydrogenase activity)를 측정하였다.
2.4 분석방법
현장에서 채취한 송림토양은 솔가리, 솔방울 및 크기가 큰 식물체를 제거한 다음, 균일하게 혼합하여 만든 500 g의 부시료로 물리화학적 특성을 분석하였다. 토성은 Kettler et al. (2001)법으로, Particulate Organic Matter (POM)은 Holliday (1986) 방법에 의해 측정하였다. 여기서, POM은 0.053-2.0 mm 크기의 유기물로 토양 유기물의 변화를 나타내는 중요한 지표이다. 토양용적밀도(bulk density)는 토양시료채취기(지름 5.4 cm × 높이 4.4 cm, 부피 100 cm3)에 토양시료를 다짐하여 넣고 105°C에서 24시간 건조 후 무게를 측정하여 산정하고, 다시 550°C에 2시간 동안 소각하여 유기물함량을 측정하였다. 토양 pH, EC 및 WHC는 산림과학원(NIFS 2014)의 방법에 의해 측정하고, 총질소(T-N), 총인(T-P) 및 유효인산 농도는 서울대학교 농생명공동기기원에서 토양오염공정시험법에 준하여 분석하였다.
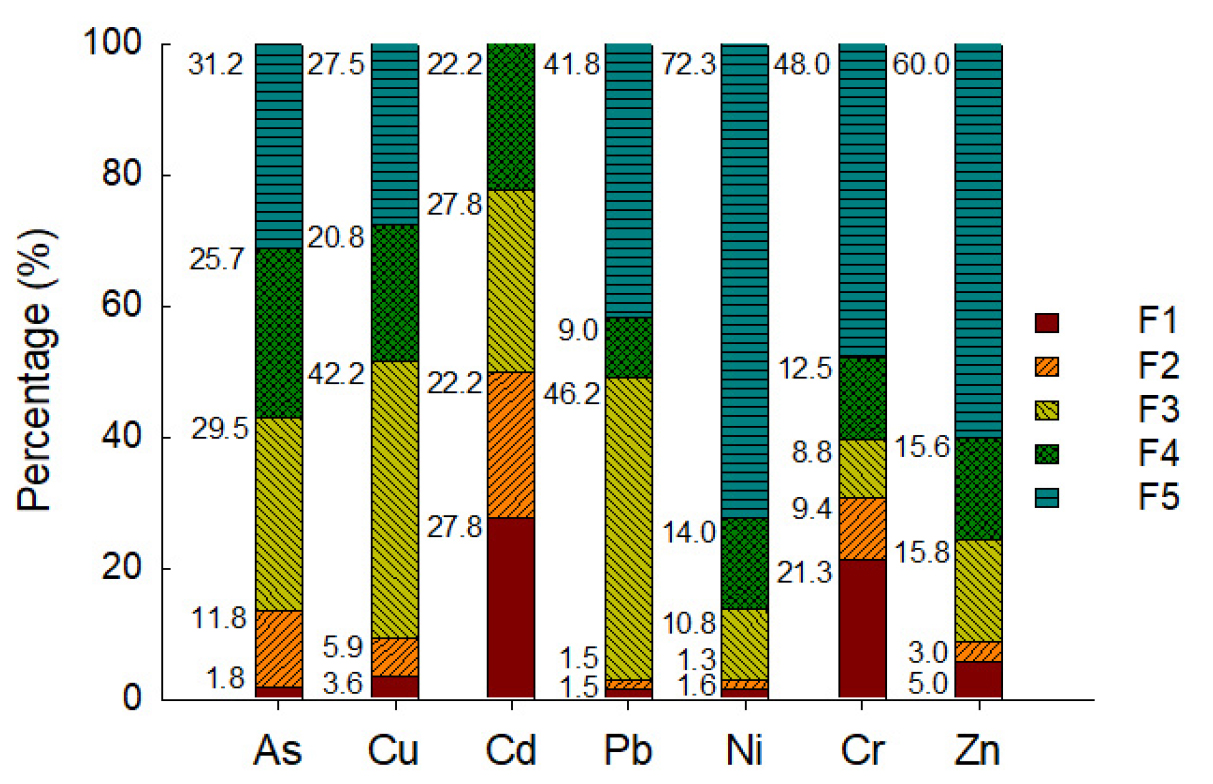
토양 내 중금속 농도 분석은 토양환경공정시험법에 준하여 실시하였고, 정도 관리를 위해 표준물질(미국 National Institute of Standard and Technology Cat. No 1515 Apple leaves)도 동시에 분석하였는데, As 표준물질에 대한 분석 오차는 8.95%이었다. 중금속은 전함량 분석방법과 Wenzel의 연속추출방법(Wenzel et al. 2001)을 사용하였다. 연속추출법은 조건에 따라 F1(비특이적 결합), F2(특이적 결합), F3(비정질 철/알루미늄 산화물 결합), F4(결정질 철/알루미늄 산화물 결합) 및 F5 (Residual)로 구분하고 있다. 연속추출법으로 분석한 중금속 농도는 식물이용가능 비율(F1+F2)을 산정할 수 있어, 식물재배정화법으로 달성할 수 있는 목표값에 대한 중요한 정보를 제공한다.
토양 DHA는 Pepper and Gerba (2004)의 방법에 의해 측정하고, 식물 건량은 70°C에서 3일간 건조하여 측정하였다. 식물 잎의 Chl.-a는 채취한 식물체를 균질기(Polytron PT 2500E)로 분쇄 후 80% acetone으로 추출하고, Eq. 1과 같이 흡광도를 측정하여 산정하였다(Lichtenthaler 1987).
여기서, 은 각각 파장 663 및 647 nm에서의 흡광도
식물의 중금속 축적능인 농축계수(biocententration factor, BCF) 및 전이계수(translocation factor, TF)는 다음 식으로 평가하였다(Eq. 1 & 2). BCF에서 식물 뿌리 농도를 사용한 것은 주변환경인 토양과 접하여 As를 직접 흡수하는 생체 기관이 뿌리이기 때문이다.
식물체내 중금속 농도에 대하여 Microsoft Excel 2016으로 95% 수준에서 유의차를 검정하였다. 이때, F-test를 선행하여 모집단의 분산의 유의차를 확인한 다음, 등분산 혹은 이분산 T-test를 실시하였다.
3. 결과 및 토의
3.1 토양의 물리화학적 특성 및 중금속 분포
송림토양의 물리화학적 특성을 측정한 결과, 모래가 91.4%인 사토로, 용적밀도는 1.45 g/cm3, 토양 pH 7.3, 유기물 함량 3.0%, T-N 1,290 mg/kg, T-P 292.15 mg/kg이며, 유효인산은 6.23 mg/kg이었다(Table 1). 송림토양은 사토임에도 불구하고 WHC가 29.8%로 높았는데, 이는 0.79%에 이르는 POM이 토양 내 aggregate 형성을 증진하였기 때문이라 판단된다(Krull et al. 2004). T-N 농도는 충청지역 농경지 50 지점의 평균값인 T-N 1,430 mg/kg과 유사하지만, P2O5는 평균값인 620.8 mg/kg의 1/100에 불과하였다(Kim et al. 2023). 전함량분석에 의한 As 농도는 26.4 mg/kg로 높지 않았는데, 오염도가 높은 지역에서 채취하였음에도 불구하고 대량으로 채취하는 과정에서 저농도 토양이 혼입되었기 때문이라 판단된다(Table 2).
Table 1.
Physico-chemical properties of the As-contaminated pine forest soil
Table 2.
Heavy metal concentrations of the pine forest soil as determined by microwave + HF aqua regia digestion method (unit: mg/kg-soil). Samples were analyzed in triplicate
| As | Cu | Cd | Pb | Ni | Cr | Zn | |
| Average | 26.4 | 8.5 | 0.1 | 13.4 | 4.2 | 10.1 | 14.0 |
| Standard deviation | 1.0 | 0.6 | 0.1 | 9.1 | 0.1 | 2.6 | 0.1 |
동일 토양을 연속추출법으로 분석한 결과, F1이 1.75%이고 F2는 11.8%로, 식물이용가능 As는 13.6%에 불과하였다(Fig. 1). 연속추출법에 의한 식물이용가능 중금속(F1 + F2)은 Cu, Cd, Pb 및 As가 각각 9.5, 50, 3.0 및 13.6%이며, 기존 연구(Jeong et al. 2011)에서 보고한 9, 40, 39, 및 10 %와 비교해서 Pb를 제외하고 모두 근사한 값이었다. Cd와 Cr은 식물이용가능 비율이 각각 50 및 30.7%로 높지만, 전함량 농도는 각각 0.1 및 10.1 mg/kg에 불과하였다(Fig. 1 & Table 2).
3.2 화분실험에서의 식물 생장 및 비소 제거
일반 고등 식물은 뿌리의 P 운송자로, 벼과식물은 Aquaporin 계열의 고효율 Si 운송자로 As를 흡수한다(Zhao et al. 2009). 흡수된 무기 As는 arsenate (AsV)종은 P 유사물질로 인식되어 산화적 인산화과정의 uncoupler로 작용하여 에너지 대사를 저해하고, arsenite (AsIII)종은 SH친화력이 높아 시스테인 혹은 티올을 포함한 효소를 불활성화한다. 또한 모든 As는 활성산소종 제거에 필요한 에너지 소모를 야기하고, 산화적 C 대사 및 N 와 S의 동화 대사를 저해하는 등의 독성이 발현된다(Finnegan and Chen 2012). 이로 인해 식물체는 에너지 손실로 인한 생장저해를 일으키거나 고사하는데, 저농도(5 mg/kg)의 As에 노출된 토마토(Lycopersicon esculentum)의 줄기와 뿌리 생체량이 각각 20 및 40% 감소한 것(Tlustoš et al. 2006)은 식물에 대한 As 독성의 대표적인 예라 할 수 있다. 또한 As에 노출될 경우 식물의 순광합성율, 클로로필 형광 및 자유아미노산 감소가 As 배제종인 시금치(Spinacia oleracea) 및 과축적종인 큰봉의꼬리(Pteris cretica)에서 모두 관측되었다(Zemanová et al. 2021).
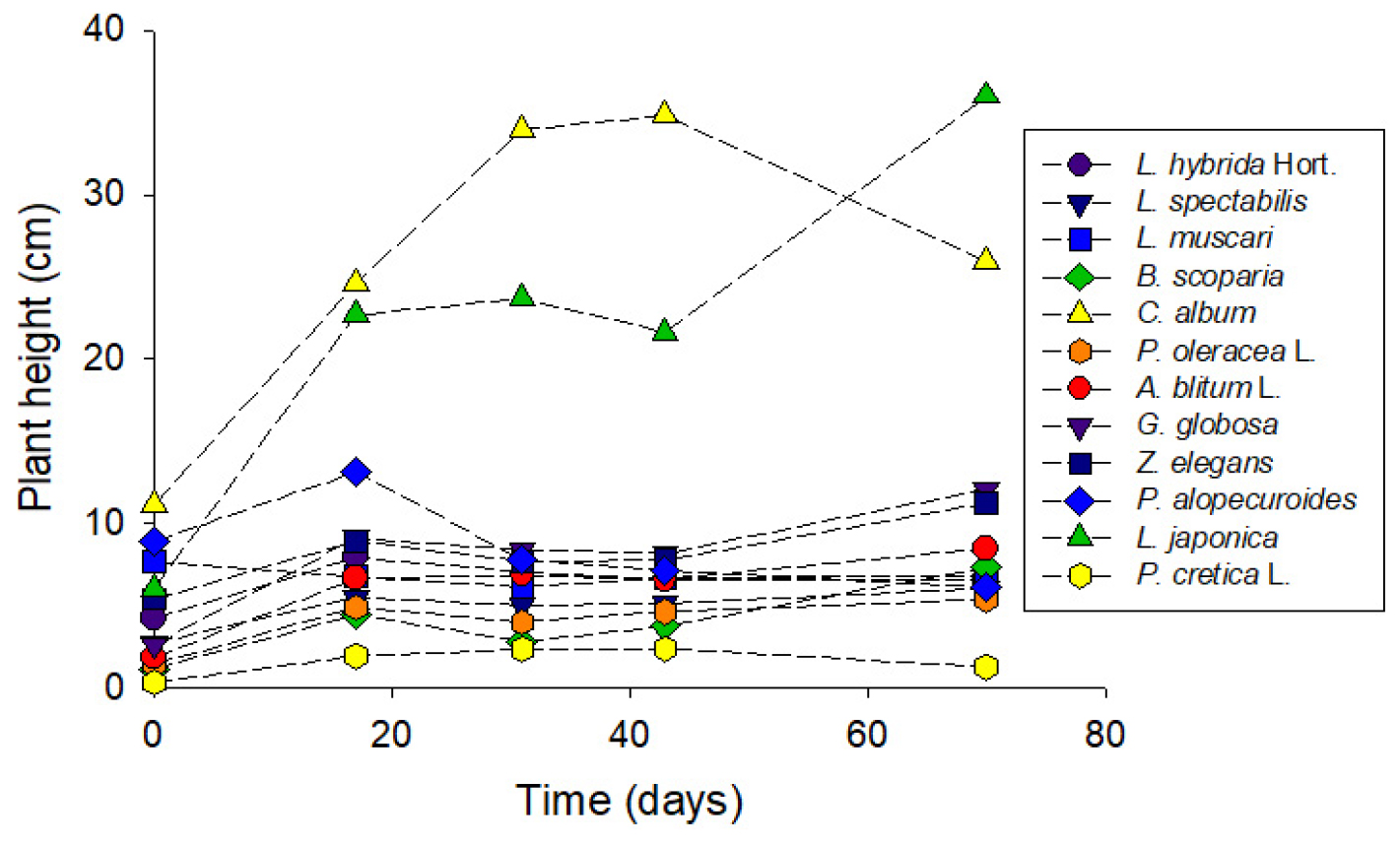
본 연구의 화분실험에서도 식물종에 따라 황변, 갈변 및 생장저해 등의 독성이 관측되었다(Fig. 2). 식물 정식 26일차에 인동덩굴(L. japonica)과 명아주(C. album)는 길이생장이 가장 활발하였고, 루피너스(Lupinus hybrida Hort.)는 새 잎이 돋았으나 맥문동(L. muscari)은 정식스트레스로 일부 잎이 낙엽이 되었다. 정식 43일차에는 수크령(P. alopecuroides)은 일부의 잎 끝단과 줄기가 황변하였고, 식물 생장이 둔화되었다. 천일홍(G. globose), 백일홍(Z. elegans) 및 루피너스는 잎의 황변이 증가하였다. 쇠비름과 맥문동은 길이생장이 중단되고 잎의 갈변이 증가하였다. 명아주는 길이생장은 활발했으나, 아래 잎들이 변색되었다. 반면 인동덩굴과 송엽국은 뿌리의 분할식재에도 불구하고 활발히 생장하였다.
정식 71일에는 다수의 식물에서 생장둔화와 잎의 황변이 발생하였다. 명아주는 개화한 다음에 시들었고, 수크령과 맥문동은 잎의 황변 및 흑변이 관찰되었고 길이생장이 감소하였다. 백일홍은 잎 수의 1/4이 황변하였고, 천일홍은 잎이 검녹색을 띄고 검은 반점이 발생하였다. 반면, 댑싸리(B. scoparia), 개비름(Amaranthus blitum L.), 송엽국 및 인동덩굴은 건강하게 생장하였다. 이상과 같이 온실 화분에서 재배한 식물의 길이생장 측정결과는 Fig. 3과 같다. 다만 송엽국(L. spectabilis)은 부피생장을 하고 쇠비름(Portulaca oleracea L.)과 개비름(A. blitum L.)은 ‘기는줄기’ 식물이어서 길이생장이 절대적 지표가 되지는 않는다.
화분 실험 종료 시에 수확한 식물체 건량은 지상부 건량 기준으로는 인동덩굴(1.74 g)>명아주(0.91 g)>송엽국(0.67 g)> 천일홍(0.58 g)>개비름(0.42 g)>수크령(0.17 g)>쇠비름(0.16 g)이었고, 지하부 건량 기준으로는 인동덩굴(2.22 g)>송엽국(0.61 g)>루피너스(0.39 g)>개비름(0.21 g)>명아주(0.13 g)>쇠비름(0.02 g)의 순이었다(Table 3). 식물체 As 함량은 지상부 기준으로는 수크령(111.95 mg/kg)>개비름(51.97 mg/kg)>댑싸리(29.85 mg/kg)>쇠비름(27.25 mg/kg)>명아주(13.59 mg/kg)>송엽국(8.49 mg/kg)순이었다. 이 중에서 수크령은 지상부 건량이 0.23, 0.19 및 0.11 g인 개체의 As 농도가 각각 23.6, 110.3 및 201.8 mg/kg으로, 생장이 좋을수록 As 지상부 농도는 감소하는 경향을 보였으나 그 원인은 명확하지 않다.
Table 3.
Dry weight and concentration of arsenic in the root and shoot of plants grown in a pot containing Janghang pine forest soil contaminated with arsenic (n=3, mean ± standard deviation)
| Plants | Dry weight (g) | As Conc. (mg/kg) | BCFa | TFb | ||
| Shoot | Root | Shoot | Root | |||
| Lampranthus spectabilis |
0.67 (±0.24) |
0.61 (±0.67) |
8.49 (±1.49) |
92.85 (±61.23) |
3.5 (±2.3) |
0.1 (±0.1) |
| Lonicera japonica |
1.74 (±0.20) |
2.22 (±0.55) |
2.87 (±1.59) |
13.63 (±6.52) |
0.5 (±0.3) |
0.2 (±0.1) |
| Gomphrena globosa |
0.58 (±0.20) |
0.28 (±0.17) |
6.20 (±3.12) |
35.50 (±3.39) |
0.9 (±0.8) |
0.2 (±0.1) |
| Liriop muscari |
0.19 (±0.03) |
0.34 (±0.14) |
1.65 (±1.35) |
10.79 (±4.61) |
0.4 (±0.2) |
0.2 (±0.1) |
| Zinnia elegans |
0.50 (±0.04) |
0.17 (±0.06) |
1.80 (±0.42) |
31.01 (±28.56) |
1.2 (±1.1) |
0.1 (±0.1) |
| Amaranthus blitum L. |
0.43 (±0.04) |
0.21 (±0.03) |
51.97 (±10.68) |
357.20 (±157.54) |
13.5 (±6.0) |
0.2 (±0.1) |
| Bassia scoparia |
0.27 (±0.01) |
0.13 (±0.09) |
29.85 (±26.90) |
14.50 (±11.06) |
0.6 (±0.4) |
1.8 (±2.6) |
| Portulaca oleracea L |
0.16 (±0.04) |
0.02 (±0.01) |
27.25 (±13.50) |
127.85 (±17.46) |
4.8 (±0.66) |
0.2 (±0.1) |
| Lupinus hybrid Hort. |
0.42 (±0.06) |
0.39 (±0.03) |
22.44 (±22.14) |
6.39 (±3.89) |
0.2 (±0.2) |
7.9 (±11.6) |
| Chenopodium album |
0.91 (±0.21) |
0.13 (±0.05) |
13.59 (±5.49) |
48.35 (±29.79) |
1.8 (±1.1) |
0.4 (±0.3) |
| Pennisetum alopecuroides |
0.18 (±0.05) |
0.04 (±0.04) |
111.95 (±89.12) |
23.97 (±8.54) |
0.9 (±0.3) |
6.1 (±6.9) |
지하부 As 기준으로는 개비름(357.20 mg/kg)>쇠비름(127.85 mg/kg)>송엽국(92.85 mg/kg)>명아주(48.35 mg/kg)>천일홍(35.50 mg/kg)>백일홍(31.01 mg/kg)>수크령(23.97 mg/kg)의 순이다. 지하부에서도 비름과 식물이 고농도 As를 축적하였다. 송엽국과 벼과식물인 수크령도 지상부에 이어 지하부 As 농도가 상대적으로 높았다. 벼과를 포함한 습지에서 생육하는 수염뿌리식물은 뿌리 표면에 As-Fe plaque를 형성하여 비소를 축적하는데(Syu et al. 2013), 본 연구에서는 확인하지 못하였다.
중금속 흡수 및 지상부 이송을 판단하는 지표로 BCF와 TF (Translocation factor)가 있다. BCF는 환경에서 중금속을 흡수하는 식물의 능력 Eq. 2를 나타내고, TF는 중금속을 뿌리에서 지상부로 이송하는 능력 Eq. 3이다. 식물재배정화에 적합한 식물은 두 값이 모두 1.0 이상의 큰 값을 가져야 하며, 특히 본 연구 목적과 같이 식물추출법에 사용되는 식물은 TF > 1.0을 기준으로 한다(Yoon et al. 2006).
BCF값이 1.0을 넘는 식물로는 송엽국(3.52), 백일홍(1.17), 개비름(13.53), 쇠비름(4.84), 명아주(1.83)이었고, 수크령과 천일홍도 축적종에 가까운 0.9 이상이었다(Table 2). TF값 기준으로는 루피너스(7.9) > 수크령(6.1) > 댑싸리(1.8) 순으로 1.0을 상회하여 정화식물로 적합한 것으로 판단된다. As 지상부 농도가 높았던 개비름 및 쇠비름의 TF는 공히 0.2로 지상부 이동이 높지 않았고, 생체량이 높은 인동덩굴은 0.2, 송엽국은 0.1이었다(Table 3). 비소를 과축적하지 않는 일반 식물 46종을 수경재배하여 As의 식물 흡수 및 TF를 측정한 결과, TF 값의 범위가 0.01~0.9이고 중앙값은 0.09에 불과하였다(Raab et al. 2007). 따라서 타 식물과 비교하면 인동덩굴과 송엽국의 TF값이 낮은 것은 아니다.
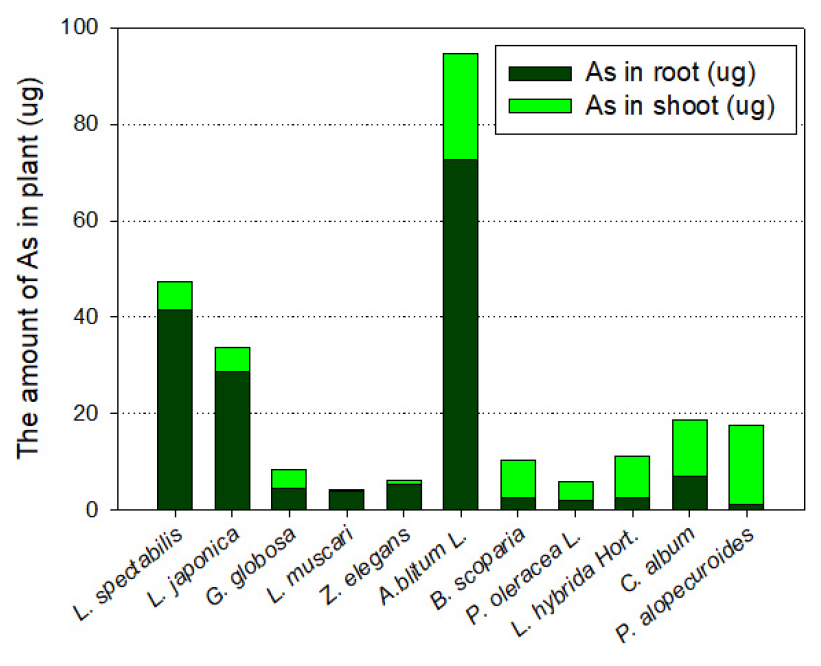
식물체가 흡수한 As량을 비교하면 Fig. 4와 같다. 식물 중에서 개비름에서의 제거량이 94.76 ug으로 가장 높았으나, 지상부 As량은 약 20%에 불과하다. 다음으로 송엽국 47.31 ug이 제거되었는데, 약 90% 정도는 지하부에 존재하고 있다. 인동덩굴은 생체 내 As 농도는 낮았으나, 식생체량이 커서 33.77 ug의 As를 제거하였다. 수크령은 송림토양에서 생장이 느리며 식물건량이 작았기 때문에 총제거량도 17.54 ug에 불과하였다. 그러나 90% 이상이 지상부에 존재하여 정화식물로서의 효용가치가 있는 것으로 판단된다.
식물체 내 As 농도가 높았던 개비름 및 쇠비름은 건량이 크지 않아 비소 제거총량이 작았다. 만약, 현장인 장암 송림토양이 아닌 다른 비소 오염지역이라면 Pteris속 고사리를 대체할 수 있는 정화식물로서의 가능성이 매우 높다. 댑싸리도 현장 토양과 낮은 조도의 생장환경에 적응하지 못하여 낮은 As 제거량을 보이고 있으나, TF가 1.83이고 지하부 생체 As 농도가 14.5 mg/kg으로, As 정화식물로서의 가능성이 있음을 보이고 있다. 반면 명아주는 생체량도 높고 지하부 비소 농도도 높아서 비소 오염의 이동성을 감소시킬 수 있는 안정화식물로 적용할 수 있다고 판단된다. 현재 장암 송림 지역에 광범위하게 식재된 맥문동은 개체당 As 총제거량이 4.13 ug으로 실험 식물종 중에서 가장 낮았다.
이상의 온실 화분실험의 As 제거량으로 판단하면, As 식물재배정화 적합종으로는 개비름, 송엽국, 인동덩굴, 수크령 및 명아주이다. 그러나 개비름은 양지식물로 현장의 낮은 조도에서는 제대로 성장하지 못하고, 명아주는 1년생으로 매년 수확과 식재를 반복해야 하기 때문에 경제성이 크게 떨어진다. 이에 송엽국, 인동덩굴 및 수크령을 유기산 첨가 화분 실험 식물로 선정하였다.
3.3 유기산 선정
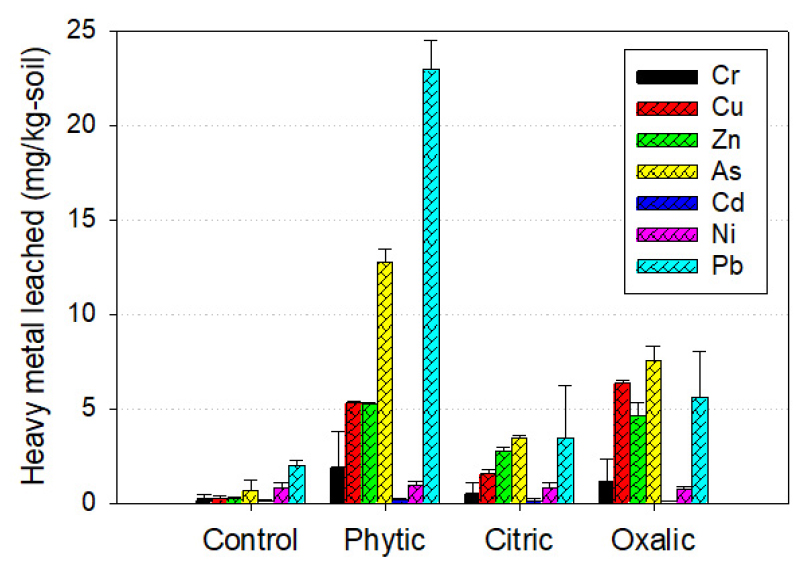
식물은 필요한 영양물질을 용해/흡수하기 위해 뿌리에서 다양한 유기산을 삼출한다. 과축적종인 봉의꼬리(Pteris vittata)와 비축적종인 보스턴고사리(Nephrolepis exaltata)의 뿌리에서 삼출되는 유기산을 비교한 결과, 봉의꼬리 뿌리에서 삼출되는 유기산은 주로 phytate 및 oxalate이며, 모든 처리구에서 보스턴 고사리에 비해 3-5배 많은 oxalate를 삼출하였고, As 스트레스 조건에서는 보스턴고사리에 비해 조건에 따라 0.46-1.06배 많은 phytate를 삼출하였다(Tu et al. 2004). 이에 송림토양 As 용해에 효과적인 유기산을 확인하기 위해 송림토양에 phytate, oxalate 및 citrate를 동일한 농도(100 mmol/kg-soil)로 첨가하고 중금속 용출 실험을 실시하였다.
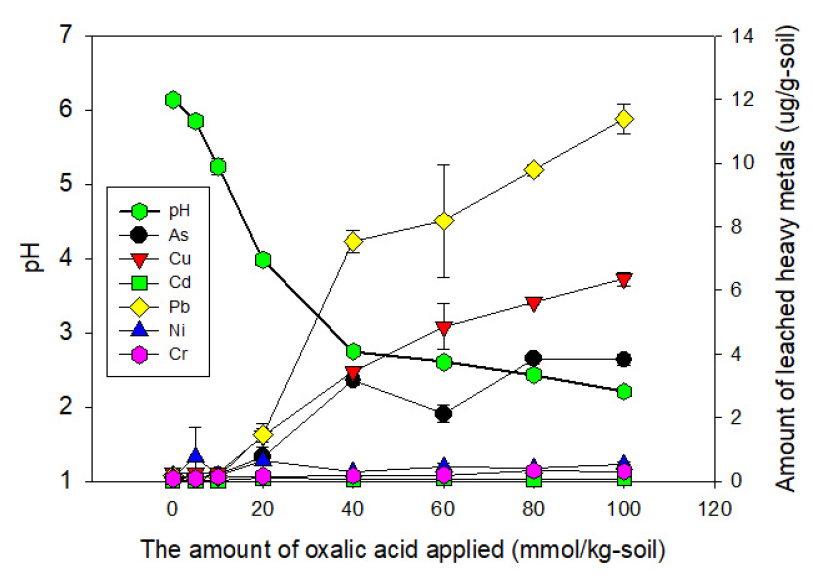
실험 결과, 추출액의 최종 pH는 phytate 1.68±0.01, oxalate 2.10±0.03, citrate 2.98±0.03이었고, 대조군 pH는 6.69±0.03이었다. 추출액의 중금속 농도는 전반적으로 phytate>oxalate> citrate 순이었으며, 각각의 처리구에서 용출된 As 농도는 phytate 1.36±0.12, oxalate 0.76±0.07, citrate 0.35±0.02 및 대조군 0.07±0.06 mg/L이었다. 이를 송림토양 1 kg당 용출되는 중금속의 양으로 변환하면 Fig. 5와 같다. 유기산 처리를 했을 때 용출되는 As량을 전함량 분석 As 농도에 대한 비율로 환산하면, phytate 48.4±2.5%, oxalate 28.6±2.8%, citrate 13.0±0.8% 및 대조군 2.5±2.0%이었다. 타 연구에서도 As와 Pb로 오염된 토양을 충진한 칼럼 반응조에서 각각의 유기산으로 용출 실험을 실시한 결과 oxalate이 citric 혹은 acetic산보다 As 용출에 효과적이라고 보고하였다(Ash et al. 2016). 본 연구의 실험 결과에 따르면, 송림토양의 식물이용가능 As 비율(F1+F2)인 12%를 유의미하게 초과하는 유기산은 phytate 및 oxalate이지만, phytate는 가격이 높아 현장에 적용하기에는 비경제적이므로 oxalate을 식물재배정화 증진을 위한 첨가제로 결정하였다.
첨가할 oxalate의 농도를 측정하기 위한 용출실험 결과는 Fig. 6과 같다. 산 주입량이 증가함에 따라 추출액 pH가 급격히 감소하다가 40 mmol/kg-soil에서 pH 감소 속도가 완만해지고, 용출되는 As 농도는 일정값으로 유지되었다. 또한 Cu와 Pb의 용출농도도 40 mmol/kg-soil에서 감소하는 경향이었다. 고농도 유기산 처리는 식물에 의한 흡수량을 초과하는 중금속 용출로 인해 중금속 유동이 증가하고 식물 생장을 저해할 수 있으므로 최대주입율을 제한하는 것이 필요하다. 이에 주입농도를 40 mmol/kg-soil로 결정하였다.
3.4 Oxalate 첨가 화분실험
식물생장상에서 증발산을 측정한 결과, 인동덩굴과 수크령의 증발산량은 화분당 30 mL/day이었고, 송엽국은 20 mL/day이었다(Fig. 7). 실험 1개월 동안 침출수 회수장치에 모인 물의 양은 송엽국 화분 2개에서 각각 1.4 및 1.5 mL, 수크령 화분 1개에서 31 mL, 그리고 인동덩굴 실험에서 8개 화분에서 1.0~5.0 mL이었다. 용출수 As 농도는 모두 30 ug/L 미만으로, 총 용출량은 오염총량에 비해 미미하였다. 실험실에서는 제한적인 관수로 인해 As 용출이 영향을 주지 않지만, 현장에서는 강수량을 제어할 수 없으므로 유기산 주입에 의한 As 용출은 매우 유의해야 할 것이라 판단된다.
주입한 oxalate에 의한 토양 pH 저하는 크지 않았다(Table 4). 인동덩굴 및 송엽국 무처리군 화분의 토양 pH는 각각 6.7 및 7.1이었으나 40 mmol/kg-soil 처리군에서 각각 0.3 및 0.5 감소한 반면, 수크령은 모든 처리군에서 토양 pH가 6.8로 일정하게 유지되었다(Table 4). 토양 DHA는 인동덩굴 39.8~56.5 mg-triphenylformazan (TPF)/g-soil, 송엽국 63.1~86.9 mg-TPF/g-soil 및 수크령 50.8~81.8 mg-TPF/g-soil로 처리군에 따라 평균값에서 차이가 있었으나 처리군 간의 변화는 크지 않았다(Fig. 8). 지상부 Chl.-a 농도는 인동덩굴 0.61~0.78 mg/g-DW, 송엽국 0.16~0.26 mg/g-DW 및 수크령 1.58~1.96 mg/g-DW으로 송엽국의 Chl.-a 농도가 가장 낮았으나, 식물종에 따른 Chl.-a 농도 차이로 동일종 간의 유의한 차이는 없었다(Fig. 8). 지상부 건량의 경우, 수크령은 40 mmol/kg-soil 처리군에서 지상부 건량 평균값(4.84 g)이 대조군(6.45 g)에 비해 다소 작았다(Table 4). 그러나 토양 DHA, Chl.-a 농도 및 지상부 건량에 대한 T-test 결과, 모든 식물 및 처리군에서 신뢰도 95% 수준에서 무처리군에 비해 통계적으로 유의하지 않았다.
Table 4.
Effects of oxalic acid addition on plant growth and soil pH of pot experiments in a growth chamber
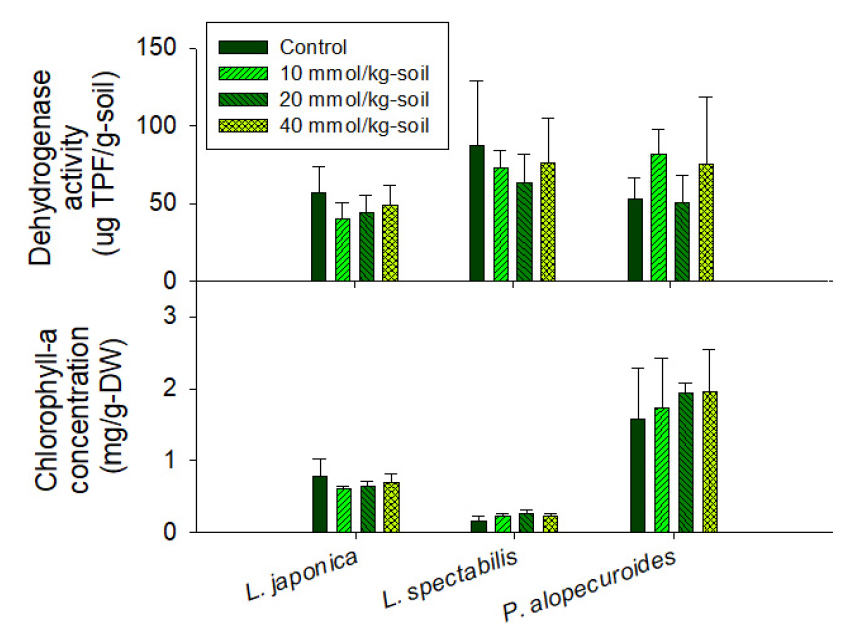
Fig. 8.
Effects of oxalic acid amendment on soil dehydrogenase activity (DHA) by measuring the amount of TPF (triphenylformazan) converted from triphenyl tetrazolium chloride by microbial respiration and the concentration of chlorophyll-a in plants grown on pot culture in a growth chamber. Error bar represents standard deviation.
자연상태에서 식물근권에서 배출되는 토양 유기산 농도는 1~1,100 mmol/kg-soil으로(Van Hees et al. 2003), 영양물질(특히 P) 흡수, 근권미생물 주활성, 무산소 내성 증가, 토양입단구조 향상 및 식물에 대한 중금속 독성 감소의 주된 동인이 된다(Jones et al. 2003). 본 연구에서 최대 주입량인 40 mmol/kg-soil을 15~20회 분할주입하였기에 1회 주입 토양 유기산 농도는 1.0~1.3 mmol/kg-soil로 자연상태 최대값에 근접한 값이며, 1.5~2일 간격으로 연속주입하였으나, 이 농도에서의 oxalate는 해당 3종 식물생장 및 토양미생물군에 스트레스를 주지 않는다는 것을 확인하였다.
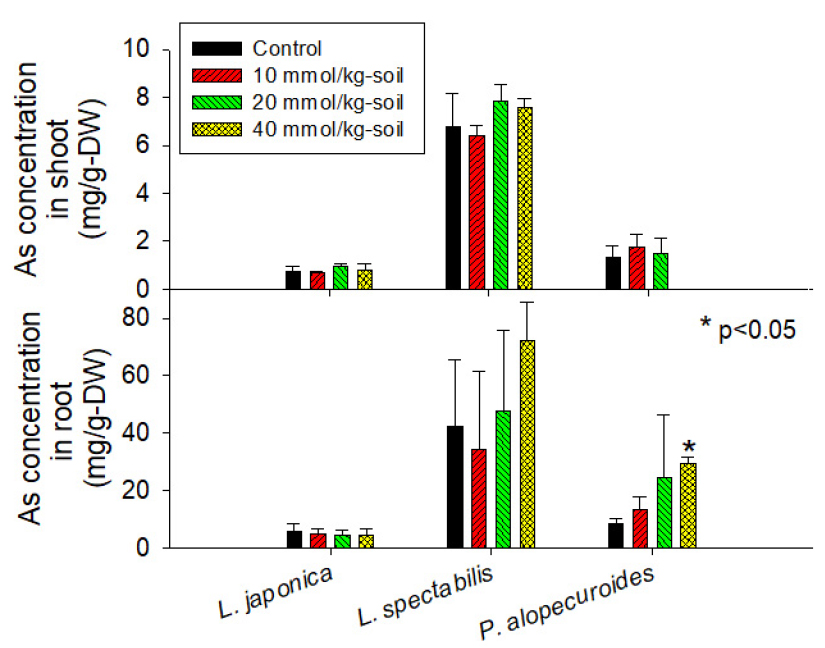
식물생장상 재배 1개월 후에 추수한 식물의 지상부 및 지하부 As 농도는 Fig. 9와 같다. 인동덩굴, 송엽국 및 수크령의 지상부 최대 농도는 각각 0.97, 7.82 및 2.64 mg/kg으로, 상기 온실에서 수행한 선별실험 결과에 비해 낮은 값을 보였다. 더불어 oxalate 처리와 지상부 As 농도 증가가 유의적이지 않았다. 식물 뿌리의 As 최대 농도는 인동덩굴 5.95 mg/kg, 송엽국 72.14 mg/kg 및 수크령 29.61 mg/kg으로, 송엽국은 근권에 고농도의 As를 축적하여 식물재배 안정화에 적용할 수 있는 식물종인 것이 확인되었다. 송엽국 및 수크령에서는 뿌리 As 평균값이 oxalate 농도에 비례하여 증가하였으나, T-test 결과 40 mmol/kg-soil 처리구에서 수크령은 95% 수준에서 뿌리 As 농도가 유의적으로(p<0.05) 증가한 반면, 송엽국은 90% 수준에서 유의적이었다(p<0.10).
토양에 존재하는 유기산은 근권미생물에 의한 이용(Wu et al. 2018), 토양입자 흡착(Van Hees et al. 2003) 및 유기산 카르복실 리간드-금속 킬레이트 결합(Osmolovskaya et al. 2018) 등으로 소모된다. 주입 유기산이 모두 중금속 용해에 사용되는 것이 아니기 때문에 저농도 유기산 주입은 식물의 중금속 흡수 증진에 현저한 영향을 주지 못할 수 있다. 예를 들어 중금속 오염토양에 3 mmol/kg의 citrate를 주입한 경우, 갓(Brassica juncea)에 의한 Cd 흡수량에 변화가 없었으나 10 mmol/kg에서는 Cd 흡수량이 1.5~3.0배 증가하였다(Wu et al. 2004). 옥수수(Zea mays L.)를 CCA (chromated Cu arsenate) 오염토양에 재배한 경우에도, citrate 10 mmol/kg의 고농도 주입토양에서 대조군 대비 1.9배의 As를 흡수하였다(Almaroai et al. 2012).
또한 유기산 주입에 의해 즉각적인 As 용해가 일어나지는 않는다. 유기산에 의한 토양오염 As의 용해실험에서 철과 결합된 As의 용해에 6일이 소요되었고, 농도는 주입한 oxalate 농도에 비례하였다(Onireti and Lin, 2016). 본 연구에서 주입한 oxalate 총량은 40 mmol/kg-soil이었지만 1개월에 걸쳐 분할주입함으로써 농도가 낮아 충분한 As 용해가 일어나지 않았을 수도 있다. 또한 온실 재배 1개월 후, 생장상 유기산 처리 1개월로 재배기간이 충분하지는 않았다. 이상의 원인으로 수크령 40 mmol/kg-soil 처리구에서만 유의적인 As 흡수 증진이 발생했던 것이라 사료된다.
4. 결 론
장항 송림의 As 오염토양을 식물재배정화법으로 처리하기 위한 적합 식물종 선별 조사를 실시하였다. 현장조사에서 맥문동, 명아주, 인동덩굴, 수크령 및 송엽국을, 문헌조사에서 루피너스(Lupinus hybrida Hort.), 쇠비름(Portulaca oleracea L.), 개비름(Amaranthus blitum L. subsp.), 천일홍, 백일홍 및 댑싸리를 선정하고, 총 11종 식물을 송림토양을 넣은 화분에 정식하고 98일간 온실에서 재배하여 식물생장 및 As 제거량을 측정하였다.
온실실험 결과, 지상부 As 농도는 수크령(111.95 mg/kg)>개비름(51.97 mg/kg) >댑싸리(29.85 mg/kg)> 쇠비름(22.44 mg/kg)>명아주(13.59 mg/kg)>송엽국(8.49 mg/kg)순이었다. As 축적 종을 나타내는 지표인 농축계수(BCF)가 1.0을 넘는 식물은 송엽국(3.52), 백일홍(1.17), 개비름(13.53), 쇠비름(4.84), 명아주(1.83)이었고, 수크령은 흡수한 비소의 90% 이상을 지상부로 이송하였기에 정화식물로서의 효용가치가 있는 것으로 판단된다. 이에 As 축적, 식물 생체량 및 현장 적용성 등을 고려하여 송엽국, 인동덩굴 및 수크령을 적용식물로 선정하였다.
식물생장상에서 송엽국, 인동덩굴 및 수크령을 각각 식재한 화분에 주기적으로 oxalate(0, 10, 20 및 40 mmol/kg-soil) 처리를 하고 식물에 의한 As 흡수 증진을 평가하였다. 각 식물체는 송림토양을 넣은 화분에 정식하여 온실에서 1개월간 재배한 다음, 식물생장상으로 이송하여 1개월간 재배하면서 oxalate 총량을 15~20회로 나누어 증발산량에 해당하는 부피로 희석하여 주입하였다. 인동덩굴은 유기산을 주입하였음에도 불구하고 지하부 As(약 5 mg/kg)와 지상부 As(약 0.8 mg/kg)에 변화가 없었다. 송엽국은 대조군 지상부 및 지하부에서 각각 42.5 및 6.8 mg-As/kg, 40 mmol/kg-soil 처리구에서 각각 72.1 및 7.6 mg/kg으로, 90% 수준에서 유의적으로(p<0.10) 증가하였다. 수크령 지상부와 지하부 As 농도는 대조군에서 각각 1.31 및 8.45 mg/kg, 40 mM 처리구에서는 2.64 및 29.61 mg/kg로, 지하부 As 농도는 유의적(p<0.05)으로 증가하였다.
그러나 유기산은 저농도 반복주입보다는 고농도 일괄주입이 효과적인 것으로 밝혀져, 현장에서 고농도 유기산 처리시 발생할 수 있는 균일 주입의 어려움과 이동성이 증가한 As의 강우 유출 가능성이 있기에 유의하여야 할 것이라 판단된다.