1. 서 론
2. 재료 및 방법
2.1 식물 재료 및 바이오폴리머 처리 조건
2.2 전해질 유출도 측정
2.3 MDA 함량 측정
2.4 바이오폴리머-Zn 이온 결합 분석
2.5 DTZ 염색
2.6 금속 함량 분석
2.7 Reverse transcription polymerase chain reaction (RT-PCR)
3. 결 과
3.1 Zn 과잉 스트레스 하에서 바이오폴리머 토양 혼합 농도에 따른 Camelina 표현형 비교
3.2 Zn 과잉 스트레스 하에서 바이오폴리머 혼합에 따른 Camelina 생리적 변화 분석
3.3 Zn 이온과 바이오폴리머 결합 분석
3.4 바이오폴리머 혼합에 따른 Camelina의 Zn 흡수량 변화
3.5 바이오폴리머 혼합 유무에 따른 CsHMA 유전자들의 Zn 과잉 스트레스 반응 분석
3.6 CsHMA3 과발현 Camelina를 이용한 바이오 폴리머의 Zn 과잉 스트레스 저감효과 비교
4. 고 찰
5. 결 론
1. 서 론
제방은 하천의 범람과 홍수피해를 방지하기 위한 구조물로 집중호우 및 월류에 의한 침식피해를 방지하기 위해 주로 콘크리트를 소재로 이용한 인공제방이 건축되고 있다 (Vahedifard et al. 2015). 하지만, 콘크리트와 같은 재료를 이용하여 제방의 내구성을 증진 시켰지만 최근 환경 파괴 문제가 대두되어 친환경소재를 이용한 제방 건설 방법이 요구되고 있다. 이러한 문제를 해결하기 위해 제방에 식물을 식재하여 제방의 강도 증진 방법이 연구되고 있지만 식물을 이용한 제방 건설은 강도에 한계가 있는 것으로 알려졌다 (Hamidifar et al. 2018). 이러한 단점을 보완하기 위해 토양입자와 결합하여 토양강도를 증진시키는 천연소재 바이오폴리머의 토양혼합을 통해 제방의 강도를 증진시키는 방법이 연구 되고 있다.
β-glucan (BG)과 Xanthan gum (XG)는 미생물 유래의 바이오폴리머이며, 토양에 혼합 시 토양 입자뿐만 아니라 토양 내 이온들과 수소 결합 또는 이온 결합을 하여 토양의 강도를 증진 시킨다고 알려져 있다 (Chang and Cho 2012, Chang et al. 2015). 이러한 효과를 이용하여 자연 친화적인 제방 건설에 대한 연구들이 진행되고 있지만 바이오폴리머의 토양혼합이 식물에 미치는 영향에 대한 연구는 부족하다. 최근 연구에서 BG-XG 조합 계열의 바이오폴리머 토양 혼합이 수분 보유력을 향상시켜 가뭄 스트레스에 대한 Camelina의 생장에 긍정적 영향을 미친다고 보고되었지만, 고염분 및 중금속과 같은 다양한 환경스트레스 조건에서 식물에 미치는 바이오폴리머의 효과는 추가 연구가 필요한 실정이다 (Lim et al. 2018).
아연 (Zn)은 식물의 생장에 필수적인 원소이다. 하지만 높은 농도의 Zn에 식물이 노출되었을 때, 식물 세포의 대사에 필요 효소 활성의 저해뿐만 아니라 산화 스트레스 등의 피해 및 황화현상 (chlorosis)을 발생시키며, 최종적으로 식물의 생장과 발달의 저해 및 생산성 감소를 야기한다 (Chaney 1993, Chen et al. 2018). 이러한 피해를 방지하기 위해 식물은 독성 이온의 방출 (efflux), 격리 (sequestration), 그리고 불활성 (chelate)과 같은 방어기작을 발달시켜왔다 (Krämer and Clemens 2005, Palmer and Guerinot 2009). 그 중에서 Heavy metal ATPase (HMA)는 식물의 생체막에 위치하는 중금속 수송 단백질로서 카드뮴 (Cd), 납 (Pb), 코발트 (Co), 그리고 Zn와 같은 중금속 이온을 원형질막 외부로 방출 (HMA2, HMA4) 또는 액포로 격리 (HMA3)시켜 중금속 내성 기작에 기여하며 (Eren and Argüello 2004, Verret et al. 2004, Seigneurin-Berny et al. 2006, Morel et al. 2009, Wong and Cobbett 2009), 식물에 과발현 (over-expression)시켰을 때 중금속 스트레스 내성이 강화되는 것으로 알려져 있다 (Park et al. 2015). 또한, HMA 단백질들은 중금속의 농도 및 노출시간에 비례하여 발현이 증가하기 때문에 중금속 스트레스의 피해 지표로 활용 가능하다.
본 연구에서는 바이오폴리머 BG 또는 XG의 Zn 이온 결합 여부뿐만 아니라 식물 (Camelina)이 Zn 과잉 스트레스에 노출 되었을 때 BG 또는 XG의 토양 혼합이 미치는 영향을 조사하고자 하였다. 이를 위하여, Zn 과잉 스트레스 및 바이오폴리머 혼합 유무에 따른 Camelina의 생육조사를 실행하였으며, 식물체 내 금속 이온의 함량을 측정하여 Zn 과잉 스트레스 피해 수준을 분석 하고, BG 또는 XG 처리 유무에 따른 HMA1/3/4 유전자의 발현 수준과 WT 및 CsHMA3 과발현 Camelina의 생리적 변화를 비교하여 Zn 과잉 스트레스에 대한 식물 생장의 토양환경 요인 혹은 식물 자체 내적 요인에 의한 효과를 비교하고자 하였다.
2. 재료 및 방법
2.1 식물 재료 및 바이오폴리머 처리 조건
본 연구에서 사용된 β-glucan (폴리칸)은 (주)폴리칸에서 제공 받았으며, Xanthan gum은 Santacruz (USA)에서 구입하여 실험에 사용하였다. 바이오폴리머와 토양 (바이오상토, (주)팜한농)을 Table 1에 표기된 비율로 혼합 후 Camelina를 파종 하였다. 파종된 Camelina는 22 ± 1°C, 16시간/8시간 (180 µmol m-2 s-1) 광주기의 배양실에서 1주 동안 발아 및 생육시켰으며, 저면 관수를 통해 1차 증류수 또는 ZnSO4 수용액 (10 mM) 50 ml를 매일 2주간 처리하였다. Zn 과잉 스트레스의 기준은 Park et al. (2015)의 연구에서 처리 된 1,500 mg/kg ZnSO4 조건을 참조하였으며, 0 mM 부터 40 mM ZnSO4 저면관수에 대한 Camelina의 표현형 및 피해증상 관찰을 통해 설정하였다 (data not shown). CsHMA3 과발현체는 CaMV 35S promoter가 구성된 pCB302-3 vector에 CsHMA3 유전자를 cloning 한 후, agrobacterium (GV3101) vacuum infiltration 과정을 통해 생성 되었다 (Park et al. 2014).
Table 1.
Biopolymer concentration for soil amendment
| Biopolymer concentration (%) | Soil (g) | Biopolymer (g) | Water (ml) |
| 0 | 900 | 0 | 270 |
| 0.25 | 897.75 | 2.25 | 270 |
| 0.5 | 895.5 | 4.5 | 270 |
| 1 | 891 | 9 | 270 |
2.2 전해질 유출도 측정
전해질유출도의 분석 실험은 Kim et al. (2013) 및 Lim et al. (2018)의 방식과 동일하게 진행되었다. Camelina 1주묘에 2주 동안 10 mM ZnSO4 수용액을 처리한 후 1차 본엽을 채집하였다. 채집한 잎을 각각 1 cm 길이로 총 4등분 하여 3차 멸균수 (double distilled H2O) 30 ml이 담긴 시험관에 넣은 후 26°C 100 rpm 조건의 궤도배양기에서 2시간 배양하였다. 그 후, sample (EC1) 및 3차증류수 (EC2)의 전기전도도를 IQ170 electrical conductivity meter (IQ scientific instruments, USA)를 이용하여 측정하였다. 그리고 측정한 sample들을 고압 멸균하여 전기전도도 (EC3)를 측정하였다. 각 sample들의 전해질유출도는 다음의 Eq. 1로 계산하였다.
2.3 MDA 함량 측정
MDA 함량 측정은 Heath and Packer (1968)의 방법을 수정 및 보완하여 실행하였다. 파종 후 1주된 Camelina 유묘에 2주 동안 10 mM ZnSO4 수용액을 처리한 후 1차 본엽을 채취하였으며, 각각의 sample을 액체질소로 동결 분쇄한 후 0.1% trichloroacetic acid (TCA)를 시료의 5배 비율로 첨가하였다. 4°C에서 15,000 rpm 조건으로 10분간 원심 분리 후 상등액 0.5 ml를 추출하였다. 추출된 sample에 0.5% thiobarbituric acid (TBA), 20% TCA 수용액을 1.5 ml 첨가한 후 95°C에서 25분간 가열하였다. 가열 후 smaple들을 얼음에서 충분히 식힌 후 4°C, 15,000 rpm 조건으로 5분간 원심분리 하였다. 원심 분리 후 추출된 상등액을 분광광도계 (Libra S50, Biochrome)를 이용하여 532 nm, 600 nm 파장에서의 흡광도를 측정 하였다. MDA의 함량은 다음의 Eq. 2로 계산하였다.
2.4 바이오폴리머-Zn 이온 결합 분석
BG 또는 XG의 Zn 결합 수준을 확인하기 위해 10 µM ZnSO4 수용액에 BG 또는 XG를 혼합한 후 0.45 µm pore의 필터로 여과하여 Zn-바이오폴리머 복합체를 제거하였다. 그 후, 여과된 수용액에 잔류한 Zn의 함량을 확인하기 위해 금속 양이온 특이적 염색시약인 1,5-diphenylthiocarbazone (DTZ)을 사용하였다. Zn 농도에 따른 염색 수준 변화를 가시화하기 위해 0 - 10 µM ZnSO4 수용액에 DTZ-methaol 용액을 처리 하였다. 그 후 분광광도계를 이용하여 각 sample들의 흡광도 값을 기반으로 표준곡선 (standard curve) 및 방정식을 확보하였다.
2.5 DTZ 염색
파종 후 1주된 Camelina WT 및 CsHMA3 과발현체 유묘를 2주 동안 ZnSO4 수용액에 처리한 후 지상부 및 1차 본엽을 채취하여 실험에 사용하였다. DTZ과 methanol을 500 mg/L 비율로 섞은 후 0.45 µm syringe filter로 여과시킨 후 염색에 사용하였다. Aluminum foil을 이용하여 암상태를 유지시킨 후, DTZ-methanol 용액에 샘플을 침지시켜 상온에서 4시간 동안 염색시켰으며 15분간 1차 증류수로 세척하였다.
2.6 금속 함량 분석
파종 후 2주된 Camelina 유묘에 2주 동안 10 mM ZnSO4 수용액을 처리한 후 지상부 전체를 채취하여 65°C 건조오븐에서 3일간 건조하였다. 건조된 식물을 막자와 막자사발을 이용하여 분쇄한 후 0.1 g의 분말을 정량하였다. 각각의 시료에 0.1N HNO3 5 mL를 첨가하여 충분히 용해될 때까지 전처리 하였다. 전처리된 시료를 동일한 부피의 증류수에 희석한 후 ICP-OES (Inductively Coupled Plasma Optical Emission Spectroscopy, Avio 500, PerkinElmer, USA) 분석을 통해 금속이온 함량을 측정 하였다.
2.7 Reverse transcription polymerase chain reaction (RT-PCR)
ZnSO4 수용액을 2주 동안 처리한 Camelina로부터 2차 본엽을 채취하여 각각 0.1 g으로 정량 하였으며 액체질소로 동결시킨 후 tissue lyser (Tisue lyser 2, Qiagen)을 이용하여 분쇄하였다. 분쇄된 sample들로부터 RiboEx Total RNA Purification Kits (GeneAll, South Korea)를 이용하여 Total RNA를 추출하였다. 각각의 total RNA sample들은 1st script cDNA synthesis kit (Takara, Japan)을 이용하여 cDNA를 합성하였다. Table 2에 열거된 HMA 유전자들의 primer 염기서열을 기반으로 RT-PCR을 수행한 후 PCR product를 agarose gel에 전기영동 시켰으며 gel document system (Geldoc XR, Biorad, USA)를 이용하여 촬영하였다. CsHMA유전자들의 발현 수준을 상대적으로 비교하기 위해 식물의 미세소관 (microtubule)인 CsActin의 발현을 함께 조사하였다.
Table 2.
Primer list of CsHMAs for RT-PCR
3. 결 과
3.1 Zn 과잉 스트레스 하에서 바이오폴리머 토양 혼합 농도에 따른 Camelina 표현형 비교
바이오폴리머를 제방 건축의 소재로 사용할 때 적정 혼합비율을 확인하는 것은 경제적 측면에서 매우 중요하며 식물의 생장과 발달에 저해가 되지 않는 적정 혼합비율의 확인은 필수적이다 (Lim et al. 2018). 바이오폴리머 처리 비율에 따른 Camelina의 생장 변화를 조사하고자 BG 또는 XG를 각각 0, 0.25, 0.5, 그리고 1%의 비율로 토양에 혼합한 후 Camelina 종자를 파종하였다. 파종 1주 후, 각각의 화분에 2주 동안 매일 증류수 또는 10 mM ZnSO4 수용액을 저면 관수 처리하였다. 그 후, Zn 과잉 스트레스에 따른 Camelina의 생체중 변화를 측정하였다. 그 결과, 0.25% BG 및 0.5% XG 이상의 바이오폴리머 혼합구에서 Zn 과잉 스트레스에 의한 Camelina의 피해가 감소되었으며 (Fig. 1 (a)), 바이오폴리머 비혼합구에 비해 생체중이 현저하게 높았다 (Fig. 1 (b)). 이 결과를 통해 BG 또는 XG를 0.5 % 이상의 비율로 토양에 혼합하였을 때 Zn 독성에 대한 피해가 현저히 감소함을 확인 할 수 있었다. 한편, Zn 과잉 스트레스 하에서 BG 또는 XG의 토양혼합 비율이 0.5% 이상일 때에는 Camelina의 생체중 증가가 유의미하지 않았다. 따라서 BG 또는 XG의 적정 혼합 비율을 모두 0.5% 로 설정하여 실험을 진행하였다.
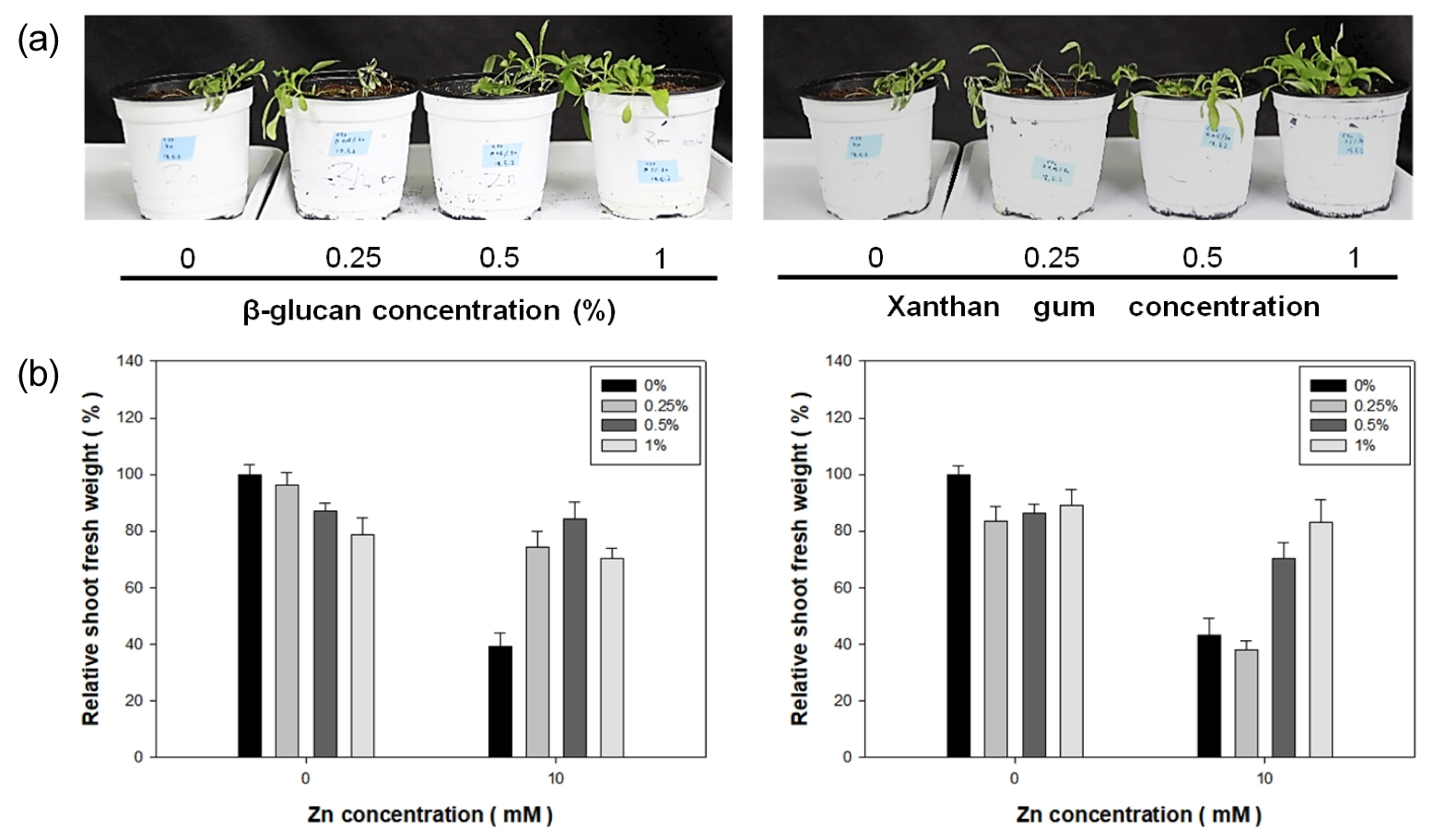
Fig. 1
Effect of growth in Camelina with various BP concentration under Zn excess stress. One-week-old Camelina seedlings grown on various concentrations of BP were treated with or without 10 mM ZnSO4 during 2 weeks. Phenotypes of Camelina under Zn stress in BG (left panel) and XG (right panel) amended soil (a). Fresh weight of Camelina shoot under Zn stress was measured from harvested samples of each BG (left panel) and XG (right panel) amended soil (b). Bars and error bars indicate means and standard error (±SE).
3.2 Zn 과잉 스트레스 하에서 바이오폴리머 혼합에 따른 Camelina 생리적 변화 분석
Zn 과잉 스트레스 하에서 0.5% 바이오폴리머 혼합에 따른 Camelina의 생장 및 피해 수준 조사 결과, BG 및 XG 혼합구와 바이오폴리머 비혼합구 모두 Zn 무처리 조건에서 생체중 차이를 보이지 않았으며, Zn스트레스 하에서 바이오폴리머 비혼합구는 약 50% 수준의 생체중 감소를 나타낸 반면 BG혼합구와 XG 혼합구는 모두 비스트레스 조건과 유사한 생체중을 나타냈다 (Fig. 2 (b)). Zn 과잉 스트레스에 대한 정량적 피해를 나타내는 지질산화 스트레스 지표로서 Camelina 1차 본엽의 MDA 함량을 분석하였다. Zn 무처리 조건에서 바이오폴리머 혼합 유무에 따른 MDA 함량 차이는 나타나지 않았지만, Zn 과잉 스트레스 하에서 BG 또는 XG 혼합구는 비혼합구에 비해 각각 32, 30% 감소한 MDA함량을 나타냈다. 한편 Zn 과잉 스트레스 유무와 관련 없이 BG 및 XG 혼합구의 Camelina는 통계적으로 유사한 MDA 함량을 나타냈다 (Fig. 2 (c)). 이 결과를 통해 바이오폴리머의 토양 혼합은 Camelina의 Zn 독성 피해를 감소시켜 세포막의 산화 및 파괴를 방지함을 확인 하였다.
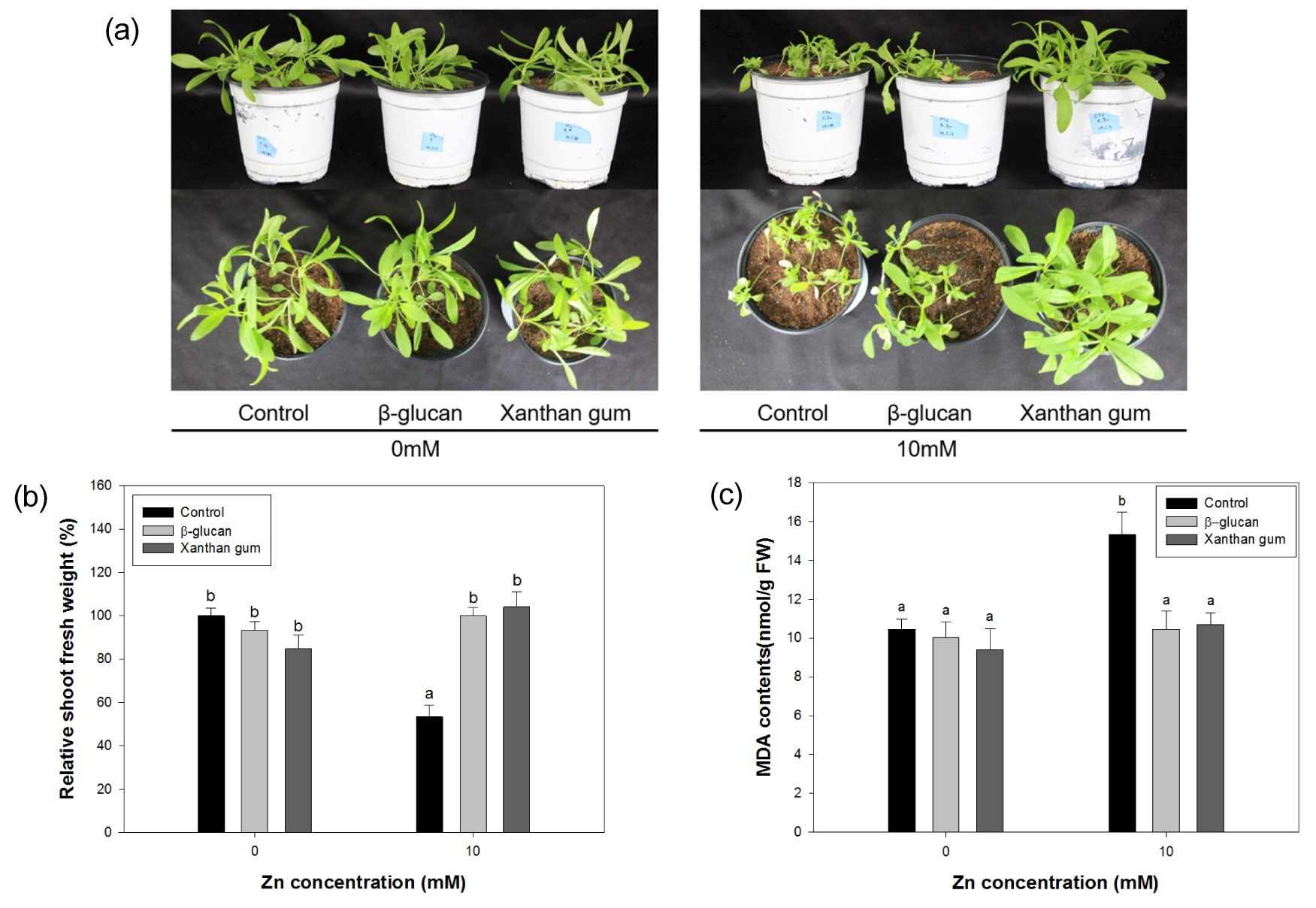
Fig. 2
Growth investigation of Camelina amended with or without biopolymers under Zn excess stress. Camelina seeds were grown on 0.5 % concentration of BG or XG amended soil for a week. The Camelina samples were treated with or without 10 mM ZnSO4 for 2 weeks (a). Fresh weight (b) and MDA contents (c) of Camelina under Zn stress was measured from shoot and first main leaf, respectively. The letters indicate the groups that were significantly different (Tukey’s test, < 0.05). Bars and error bars indicate means and standard error (±SE).
3.3 Zn 이온과 바이오폴리머 결합 분석
바이오폴리머는 다양한 무기이온과 결합한다고 알려져 있다 (Al-Wabel et al. 2015, Puga et al. 2015). 바이오폴리머의 토양 혼합이 Zn 독성으로부터 식물을 보호하는 효과는 바이오폴리머-Zn의 사이의 결합에 의한 것이라 판단하였으며, BG또는 XG의 Zn 결합 수준을 DTZ 염색을 이용하여 확인하였다. Zn 이온 농도에 따른 DTZ 염색수준은 정비례하게 나타났으며 (Fig. 3 (a)), 각각의 흡광도를 측정한 후 표준곡선 (standard curve) 및 방정식을 확보하였다 (Fig. 3 (b)). Zn-DTZ 표준곡선 및 방정식을 통해 BG 및 XG의 Zn 이온과 결합능 (binding capacity)을 분석한 결과, 두 샘플 모두 바이오폴리머 비혼합구에 비해 Zn 함량이 약 55% 수준으로 감소하였음을 확인하였다 (Fig. 3 (c)). 이 결과는 Zn 이온과 BG 또는 XG의 결합 가능성을 보여주고 있으며, 추가적으로 Zn이온과 바이오폴리머의 결합이 필터 여과로 유실되지 않는 수준으로 견고하게 유지됨을 확인할 수 있었다. 따라서 Zn 과잉 스트레스 하에서 BG 또는 XG 토양 혼합에 의한 Camelina의 Zn 독성 피해 감소는 바이오폴리머의 Zn 이온 흡착 효과에 의한 것이라 판단된다.
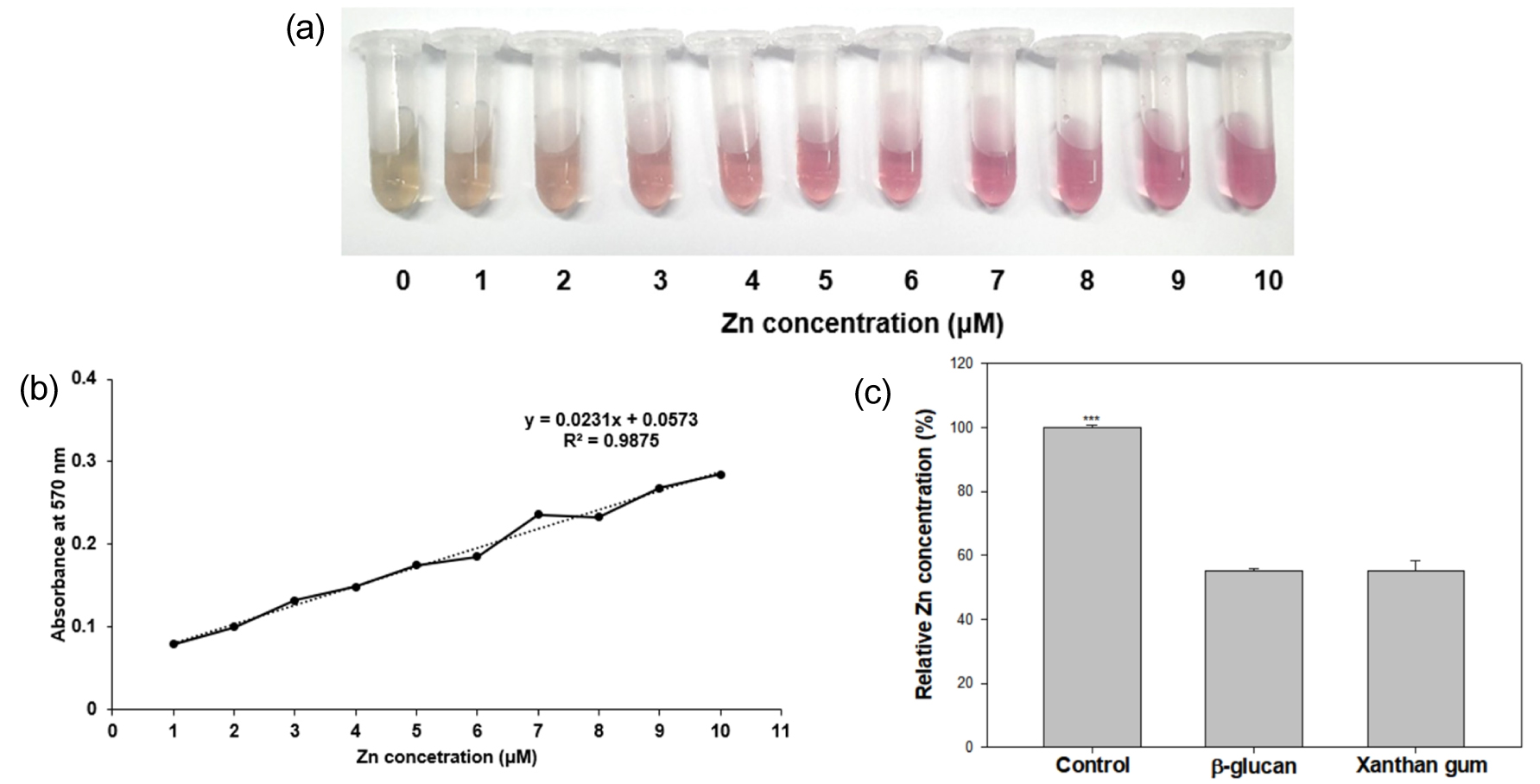
Fig. 3
Binding capacity assay of biopolymers using DTZ staining method. DTZ-methanol and 0 to 10 μM ZnSO4 solutions were mixed of 1:9 ratio (a). Each absorbance of Zn-DTZ complex was measured for standard curve and equation (b). BG and XG was mixed with 10 μM ZnSO4 solution. The mixtures were incubated for 3 h at room temperature, then filtered by 0.45 μm pore syringe filter. Absorbance of the filtrates were measured at 570 nm using spectrophotometer (c). Bars and error bars indicate means and standard error (±SE).
3.4 바이오폴리머 혼합에 따른 Camelina의 Zn 흡수량 변화
식물체 수준에서 바이오폴리머 혼합에 의한 Zn 과잉 스트레스 피해 경감을 확인하고자, 2주 동안 Zn 과잉 스트레스를 처리한 Camelina의 지상부를 수확하여 DTZ 염색을 수행하였다. 그 결과, Zn 비스트레스 조건에서 BG 또는 XG 혼합 유무에 무관하게 입과 줄기는 염색되지 않았지만, Zn 과잉 스트레스 하에서 바이오폴리머 비혼합구의 잎과 줄기는 전체조직이 붉은색 염색되었다. 한편, BG 또는 XG 혼합구는 바이오폴리머 비혼합구에 비해 낮은 수준으로 염색되었으며 주로 체관부 (phloem) 조직이 염색되었다 (Fig. 4 (a)). 동일한 실험 조건에서 ICP-OES 분석을 통해 식물체 내부로 이행된 Zn 이온의 함량을 측정한 결과, Zn 비스트레스 조건에서 각 혼합구들의 Zn 함량은 차이가 없었다. Zn 과잉 스트레스 노출에 의해 바이오폴리머 비혼합구는 Zn 비스트레스 조건에 비해 식물체 내 Zn 함량이 약 8배로 증가한 반면, BG 또는 XG 혼합구는 Zn 비스트레스 조건과 통계적으로 유사한 Zn 함량을 나타냈다 (Fig. 4 (b)). 이 결과를 통해 바이오폴리머의 토양 혼합이 뿌리로 흡수되는 Zn 이온을 감소시켜 Camelina에 미치는 Zn 독성 피해를 경감시키는 것을 확인하였다.
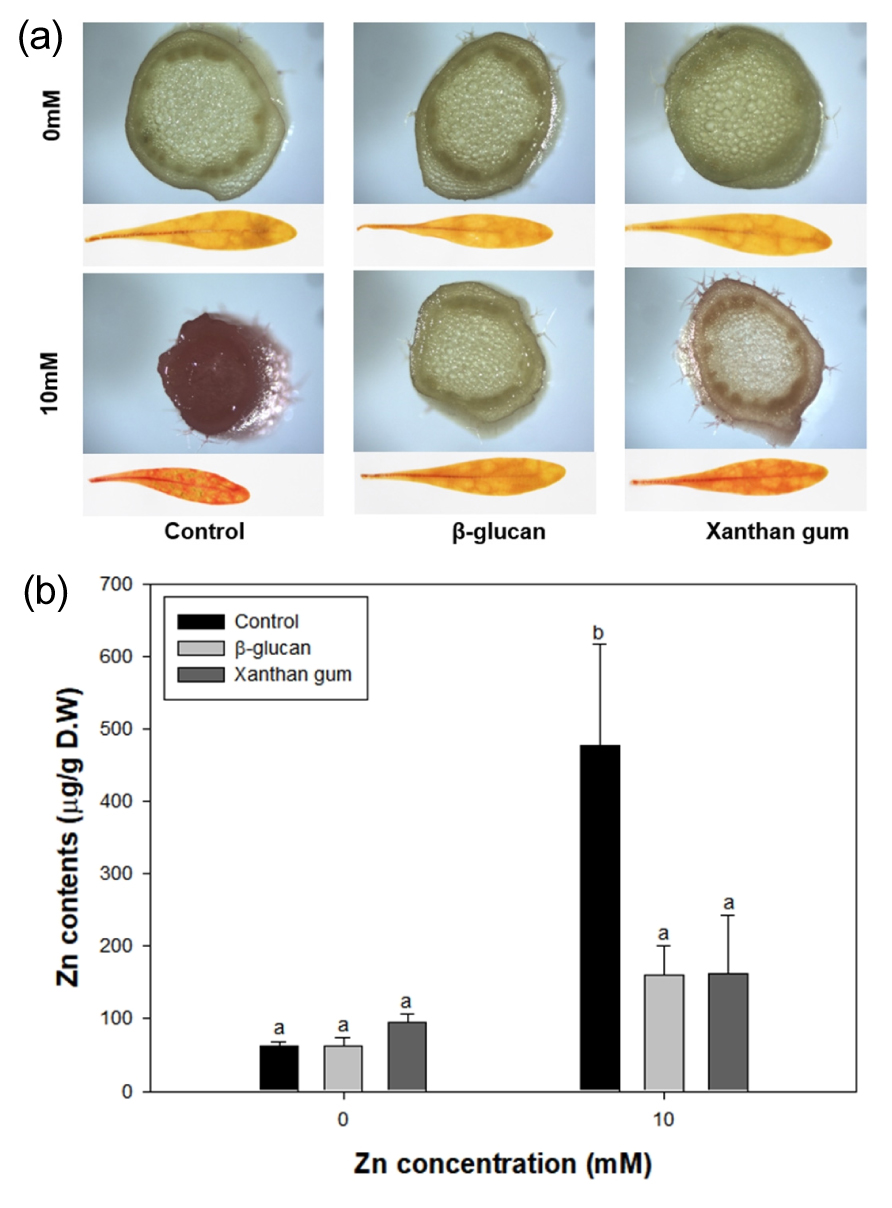
Fig. 4
Comparison of Zn contents in Camelina by biopolymers amended soil under Zn excess stress. Plant were grown on BG and XG amended soil for a week, then treated with 10 mM ZnSO4 during 2 weeks. The Camelina stems and leaves were stained with DTZ-methanol soultion (a). Zn contents were measured in shoot (b) using ICP-OES. The letters indicate the groups that were significantly different (Tukey’s test, P < 0.05). Bars and error bars indicate means and standard error (±SE).
3.5 바이오폴리머 혼합 유무에 따른 CsHMA 유전자들의 Zn 과잉 스트레스 반응 분석
이전의 연구에서 중금속 스트레스 노출에 의해 발현이 유도되는 Camelina의 중금속 수송단백질 CsHMAs의 특성이 보고 된 바 있다 (Park et al. 2014). 이들 중에서 CsHMA1/3/4 단백질은 각각 엽록소, 액포막, 그리고 원형질막에 위치하며 세포질 내 과도한 Zn이온을 세포외부 또는 액포 내부로 수송하는 역할을 하며 높은 농도의 중금속 이온에 반응하여 발현이 증가한다고 보고되었다 (Seigneurin-Berny et al. 2006, Courbot et al. 2007, Takahashi et al. 2012, Liu et al. 2017). 이러한 CsHMA 유전자들의 발현 수준을 지표로 활용하여 바이오폴리머 혼합 유무에 따른 Camelina의 분자적 수준의 반응을 확인 하였다 (Fig. 5). Zn 비스트레스 조건에서 CsHMA1의 발현은 바이오폴리머 혼합 및 비혼합구 모두에서 발현이 일정하게 유지되었으며, CsHMA3 및 CsHMA4는 모두 발현이 유도되지 않았다. Zn 과잉 스트레스 처리 2주 후, CsHMA1의 발현은 BG 또는 XG 혼합구와 바이오폴리머 비혼합구 모두에서 Zn비처리 샘플들과 유의미한 차이를 나타내지 않았다. 한편, Zn과잉 스트레스 하에서 바이오폴리머 비혼합구의 CsHMA3의 발현이 Zn 비스트레스-바이오폴리머 비혼합구에 비해 높은 수준으로 유도되었지만, BG 또는 XG 혼합구에서는 CsHMA3의 발현이 증가하지 않았다. 한편, 식물의 지상부에 비해 지하부에서 주로 발현된다고 알려진 CsHMA4의 경우 (Park et al. 2014), Zn처리 유무에 따른 발현 변화가 확인 되지 않았다 (Fig. 5). 이 결과는, 바이오폴리머의 토양 혼합이 CsHMA3의 발현을 유도시키지 않을 수준으로 Camelina에 미치는Zn 독성 피해를 저감시킴을 의미한다.
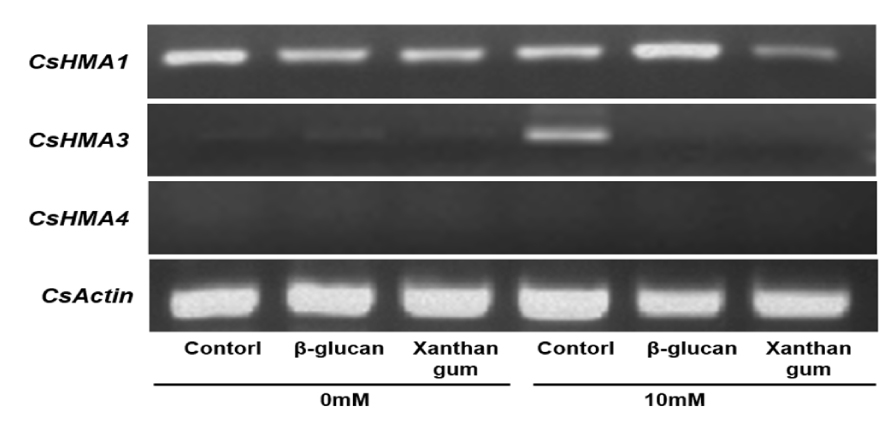
Fig. 5
Expression of HMAs in Camelina leaves by biopolymers amended soil under Zn excess stress. The cDNA samples were prepared from second leaves of Camelina under Zn excess stress for 2 weeks. The CsHMA genes were amplified by RT-PCR using each primers. Expression of CsACTIN gene was compared as internal control.
3.6 CsHMA3 과발현 Camelina를 이용한 바이오 폴리머의 Zn 과잉 스트레스 저감효과 비교
중금속 수송단백질 CsHMA3를 과발현 (over-expression, OX) 시킨 Camelina는 Cd, Pb, 그리고 Zn과 같은 중금속 스트레스로부터 내성이 증진된다는 보고가 있다 (Park et al. 2014). CsHMA3 OX Camelina는 중금속 스트레스 피해 저감효과에 대한 모델로서, 야생형 (WT)과 함께 BG 또는 XG 혼합구에서 생육시킨 후 Zn 과잉스트레스에 대한 피해 반응을 비교하였다. CsHMA3의 과발현 여부는 WT 및 CsHMA3 OX Camelina에서 RT-PCR을 통해 확인하였다 (Fig. 6 (a)). Zn 과잉 스트레스 하에서 바이오폴리머 비혼합구의 WT은 심각한 생장저해를 받았지만 CsHMA3 OX Camelina는 WT에 비해 피해를 받지 않았다. 반면, BG 또는 XG 혼합구의 WT은 Zn 과잉 스트레스에 대한 생장 피해가 감소하였으며 CsHMA3 OX Camelina와 유사한 수준의 생장을 나타냈다 (Fig. 6 (b)). 동일한 조건에서 WT 및 CsHMA3 OX Camelina 1차 본엽의 전해질 유출도를 측정한 결과, Zn 과잉 스트레스에 의해 바이오폴리머 비혼합구 WT의 전해질유출도는 현저히 증가하였지만, BG 또는 XG 혼합구의 WT을 포함하여 모든 혼합구 및 비혼합구의 CsHMA3 OX Camelina는 전해질유출도의 증가를 나타내지 않았다 (Fig. 6 (c)). 식물체 내로 이행된 Zn 이온 함량을 비교하기 위해 WT 및 CsHMA3 OX Camelina의 1차본엽을 DTZ으로 염색 하였다. 그 결과, BG 또는 XG 혼합구의 WT은 CsHMA3 OX Camelina 와 유사한 염색 수준을 나타냈다 (Fig. 6 (d)). 한편, CsHMA3 OX Camelina의 염색 수준은 바이오폴리머 비혼합구 보다 BG 또는 XG 혼합구에서 더 옅게 염색 되었다. 이 결과를 통해, WT에서 BG 또는 XG의 토양 내 Zn과잉 스트레스 저감 효과는 내생적으로 Zn 내성을 유도시킨 CsHMA3 OX Camelina와 유사한 수준인 것으로 판단하였다.
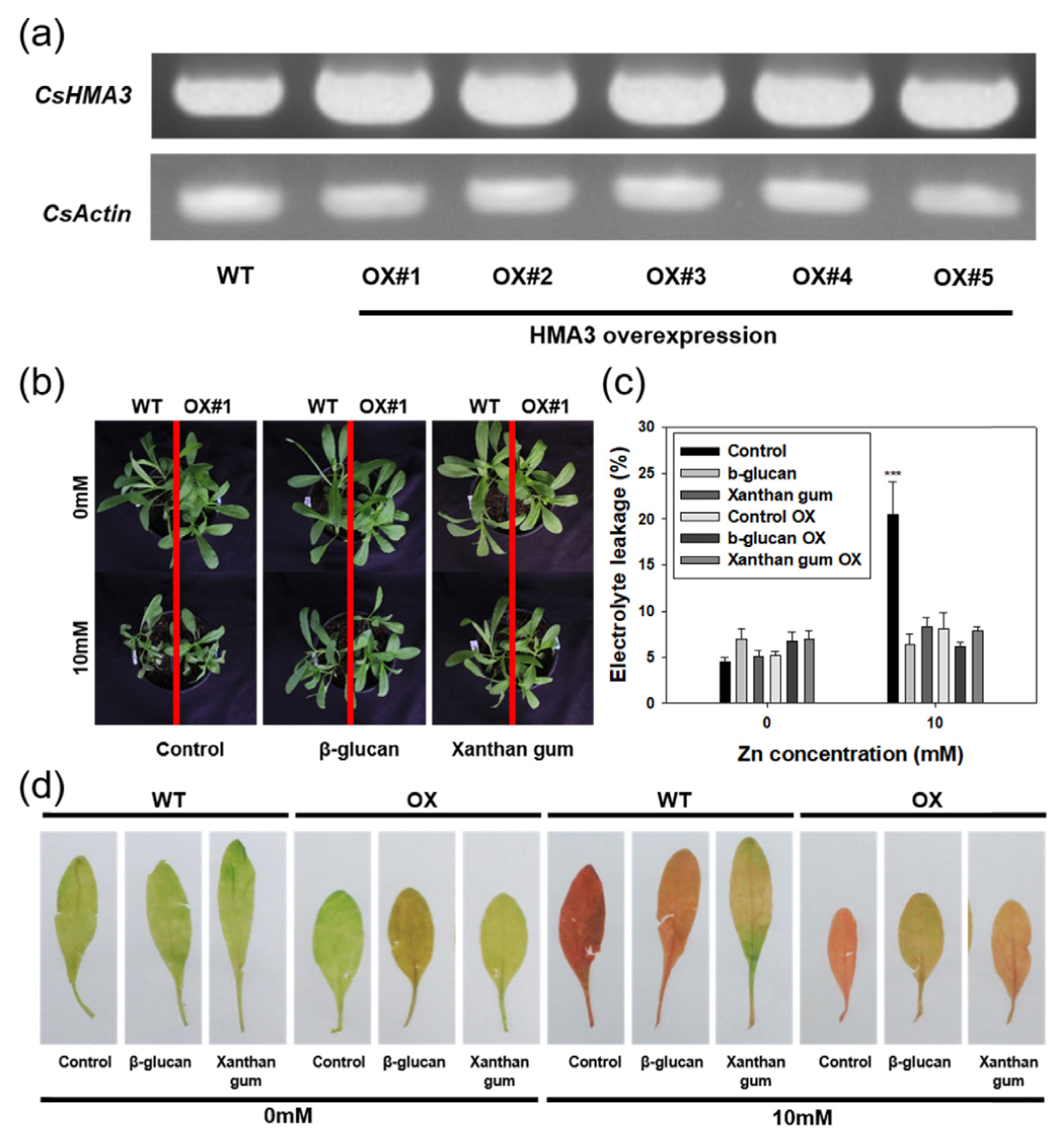
Fig. 6
Comparison of Zn excess damages in WT and CsHMA3 over-expressed (OX) Camelina grown on BG and XG. Over-expression of CsHMA gene in transgenic Camelina has been confirmed through RT-PCR (a). WT and CsHMA3 OX Camelina were grown on BG or XG amended soil to compare Zinc damage reduction between biopolymer and Zn-tolerant transgenic Camelina under zinc excess stress. To evaluate Zn excess damages in WT and CsHMA3 OX Camelina, the plants were treated with 10 mM ZnSO4 for 2 weeks, then phenotypical change (b), electrolyte leakage (c), and Zinc uptake rate of leaves (d) were observed. Zn contents of WT and CsHMA3 OX Camelina was observed using DTZ staining method. Bars and error bars indicate means and standard error (±SE). Asterisks indicate P < 0.001 (student’s t test).
4. 고 찰
제방은 하천과 지상의 경계로서 농업, 공업, 생활 하수, 그리고 광산업으로 인한 중금속 오염이 쉽게 일어날 수 있는 지역이다. 따라서 바이오폴리머 소재로 건축된 제방에서 중금속을 포함하는 오염원에 대한 식물의 피해 반응을 조사하는 것은 중요하다고 할 수 있다 (Babcsányi et al. 2020). Zn는 식물의 생장에 필수적인 영양원소이지만 중금속으로 분류되어 있으며 과량의 Zn 이온은 식물에 독성 피해를 입힌다 (Clijsters and Van Assche 1985, Vassilev et al. 2011). 식물이 고농도의 Zn에 노출되면 효소의 활성 저하뿐만 아니라 길항작용으로 인한 Fe결핍 증상이 나타나며 결과적으로 생장과 발달이 억제된다 (Arrivault et al. 2006). 하지만, Fe를 추가적으로 처리하면 Zn 과잉 스트레스에 대한 식물의 생장 및 표현형이 회복된다는 보고가 있다 (Fukao et al. 2011, Shanmugam et al. 2011). 이처럼 식물은 영양소들의 항상성 조절이 생장에 필수적이기 때문에 금속 이온 독성에 대한 방지책의 수립은 매우 중요하다.
이전의 보고들에서 토양에 유기물질들을 혼합하면 식물체 내로 이행되는 Zn, Cd, 그리고 Pb와 같은 중금속 이온이 감소된다고 보고된 바 있다 (Al-Wabel et al. 2015, Puga et al. 2015). 본 연구에서 사용된 XG는 Ca, Mg, Mn, Zn, Cd, Pb와 같은 2가 금속 양이온들과 결합한다고 보고 되어 있으며 (Bergmann et al. 2008), XG를 이용해 수용액에서 Pb와 Zn를 제거하는 방법이 개발된 바 있다 (Ghorai et al. 2014, Jakóbik-Kolon et al. 2017). 이러한 선행연구들은 토양에 혼합된 바이오폴리머가 Zn 이온과 결합 하여 식물체로 이행되는 Zn 이온을 억제하여 식물체에 과도한 양의 Zn가 축적되어 나타나는 피해를 방지한다는 우리의 실험 가설을 지지해준다.
본 연구에서 바이오폴리머 혼합구에서 생육시킨 Camelina는 상대적으로 바이오폴리머 비혼합구에 비해 낮은 수준의 Zn 과잉 독성피해를 나타냈다 (Fig. 1 and Fig. 2). Zn 과잉 스트레스 하에서 바이오폴리머 혼합구의 Camelina는 비혼합구에 비해 생체중이 증가하였으며, MDA 함량과 같은 생리적 지표 분석 결과가 Zn 비스트레스 조건과 유사 하였다 (Fig. 2). 이러한 결과들은 바이오폴리머가 Zn 과잉 스트레스를 저감시켜 식물세포의 보호 효과가 있음을 나타내고 있다. 더불어 Zn 비스트레스 조건에서 바이오폴리머 혼합 유무와 무관하게 Camelina의 생장은 유사하게 나타나고 있어서, 이 결과는 바이오폴리머의 혼합이 그 자체로는 Camelina 생육에 부정적 영향을 미치지 않음을 시사한다 (Fig. 2).
본 연구에서 바이오폴리머 혼합 및 비혼합 토양에서 생육시킨 Camelina의 DTZ 염색과 ICP-OES 분석을 통해 Zn의 함량을 측정하였다. 바이오폴리머-Zn 결합 확인 및 잔여 Zn 이온 정량 실험에서 BG 또는 XG와 Zn 이온 사이의 결합을 확인하였으며, 동일한 질량의 BG와 XG는 유사한 수준의 Zn 이온 수용능을 가지고 있음을 확인하였다 (Fig. 3). DTZ 염색 실험에서, Zn 과잉 스트레스에 노출된 Camelina의 잎과 줄기는 전조직이 선명한 붉은색으로 염색되었지만, BG 또는 XG 토양 혼합에 의해 염색의 정도가 현저히 낮아졌으며, 특히, BG 혼합구는 줄기에 염색 여부가 확인되지 않았고 XG 혼합구의 줄기는 체관부 조직에 낮은 수준으로 염색되었다. 이 결과는, BG 또는 XG의 토양 혼합이 식물조직의 Zn 독성 피해 완충작용을 하였음을 시사한다. 또한, ICP-OES를 이용한 Camelina의 Zn 축적량 분석 결과 또한 동일하였다.
중금속 수송 단백질 HMA3는 식물 세포의 액포막에 위치하는 P1B type ATPase로 분류되며, Zn 과잉 스트레스에 의해 발현이 유도되어 Zn 독성 방어 기작에 관여한다고 보고된 바 있다 (Becher et al. 2004, Park et al. 2014). 바이오폴리머 혼합 유무에 따른 Camelina의 Zn 과잉 스트레스 반응을 확인하고자, Zn의 수송 및 격리 그리고 세포의 이온항상성 유지에 기여하는 HMA 유전자들의 발현 양상을 조사하였다. 바이오폴리머 비혼합구에서 Camelina가 Zn 과잉 스트레스에 노출될 경우 HMA3의 발현이 증가 하였으며, 이러한 변화는 Zn 독성을 방어하기 위한 중금속 이온 격리 기작이 작용한 것으로 판단된다 (Fig. 5). 그리고 0.5% 비율로 바이오폴리머를 토양에 혼합하였을 때, Zn 과잉 스트레스에 대한 CsHMA3의 발현은 유도되지 않아, 바이오폴리머가 식물체 내 Zn 이행에 충분히 영향이 있음을 의미한다. 같은 HMA family로 비교된 CsHMA1은 식물의 엽록소에 위치하며 Zn 외에도 구리 (Cu)의 수송에도 관여되어 있다 (Seigneurin-Berny et al. 2006, Kim et al. 2009). 따라서 HMA1은 식물의 광합성과 밀접한 관련이 있기 때문에 발현이 항시 유지되고 있으며, 다른 HMA 유전자들에 비해 높은 수준의 발현이 유지되고 있었다. HMA4는 원형질막에 위치하는 중금속 수송체로서 주로 식물의 뿌리에 발현이 높다고 알려져 있다 (Verret et al. 2004, Park et al. 2014). 따라서 바이오폴리머 혼합 유무와 관련 없이 HMA4의 발현이 유도되지 않았던 결과는 식물의 샘플을 잎에서 채취했기 때문으로 판단된다. 이상의 결과를 종합해 보면, 기존에 알려진 HMA 유전자들의 발현 특성과 우리의 실험 결과는 일관성이 있으며 중금속 피해 반응에 대한 지표로서 유효하다고 판단된다.
바이오폴리머 처리유무에 따른 HMA3 유전자의 Zn 과잉 스트레스 반응 결과를 바탕으로, BG 또는 XG 혼합으로 인한 식물의 중금속 피해 경감 수준을 평가하고자 Zn 과잉 스트레스 내성이 증진된 CsHMA3 OX Camelina를 대상으로 비교 실험을 수행하였다. 그 결과, BG 또는 XG의 토양 혼합과 같은 외부적 요인에 의한 Camelina의 Zn 독성피해와 식물체 자체에 Zn 과잉 스트레스 내성을 증진시킨 CsHMA3 OX Camelina의 피해가 유사한 수준으로 감소됨을 확인 할 수 있었다 (Fig. 6). 흥미롭게도, DTZ 염색실험 결과, CsHMA3 OX Camelina는 BG 또는 XG 혼합구에서 생육하였을 때 바이오폴리머 비혼합구에 비해 더 효율적으로 Zn 흡수를 방지 시킬 수 있음을 확인하였다. 이 결과는 식물의 중금속 스트레스 내성 증진을 위한 내/외부적 요인을 복합적으로 조성하였을 때 중금속 독성 피해 감소 효과를 보강 할 수 있다는 정보를 제공한다. 결론적으로, 바이오폴리머의 토양 혼합이 식물의 생장에 부정적인 영향을 미치지 않으며 Zn 독성 피해를 저감시켜 Zn 오염토양으로부터 식물의 생존을 강화 시킴을 확인 하였다. 이 연구 결과들은 바이오폴리머 기반으로 건축된 친환경제방에서 자생하는 식물들의 Zn 뿐만 아니라 다른 중금속 스트레스에 대한 기초 연구 자료로서 유용할 것이라 판단된다.
5. 결 론
본 연구는 바이오폴리머의 금속이온 결합 특성을 이해하고 식물에 미치는 영향을 규명하고자 하였다. 바이오폴리머의 중금속 이온과 흡착하는 속성은 다양한 산업에서 활용되고 있지만 식물에서의 중금속 스트레스에 대한 연구는 미비하여 본 연구에서 수행된 바이오폴리머를 이용한 Camelina의 Zn 독성 스트레스 저감 수준 분석은 BG 및 XG를 소재로 건축된 친환경제방에서 식물의 환경 적응성 평가에 중요한 정보를 제공할 것이라 판단된다. 또한, 이 연구는 광업, 농업, 그리고 생활하수 등으로 오염된 토양에서 안정적인 작물의 생산을 위한 바이오폴리머의 활용을 제안하며, 친환경 제방뿐만 아니라 Zn 오염 토양의 식생 복원 및 농업환경 조성에서도 활용이 가능할 것이라 사료된다. 한편, 바이오폴리머의 토양 혼합이 Zn 이외의 필수영양원소 결합을 야기하여 식물의 양분흡수를 저해하는지에 대한 추가적인 연구가 필요할 것으로 판단된다.




