1. 서 론
2. 재료 및 방법
2.1 실험어 및 사육 관리
2.2 실험구 설정 및 수온조절
2.3 생존율 및 혈액분석
2.4 통계처리
3. 결 과
3.1 혈액성상 반응 (Hematological response)
3.2 호르몬 반응 (Hormonal response)
4. 고 찰
5. 결 론
1. 서 론
어류가 스트레스 요인에 접하게 되면, 체내 코티졸 (cortisol)의 과다분비로 생리학적 불균형을 일으킨다 (Hur et al. 2008). 어류의 항상성 유지를 위한 스트레스 지표 호르몬으로는 코티졸이 있으며, 안정시 혈중농도는 매우 낮지만 급격한 스트레스를 받게 되면 그 농도는 순식간에 수십배로 증가한다 (Hur et al. 2008). 많은 어류에서 안정시 혈중 코티졸 값이 제시되어 있으나, 본 연구에 사용한 붕어 및 잉어에 대한 혈액 안정값은 제시된 바 없다. 일반적으로 어류가 스트레스를 받게 되면 체내 항상성 유지를 위한 코티졸 호르몬이 분비되나, 스트레스의 강도가 높거나 반복적으로 받게 되면, 어류는 항상성 유지 능력을 상실하여 생리적 장애, 번식과정의 혼란, 질병에 대한 저항성 감소가 나타나게 되고 최종적으로 폐사에 이르게 된다 (Barton and Iwama 1991). 어류가 스트레스를 받을 때 분비되는 코티졸의 작용으로 인하여 당신생 효소의 활성이 높아져 글루코스 (glucose)의 분비량이 증가한다 (Hur et al. 2019). Barton and Iwama (1991)는 스트레스에서 이러한 증가현상을 스트레스의 1차반응 (코티졸의 증가)에 따른 2차반응의 결과 (글루코스의 증가)라고 정의하였다. 어체 혈액의 AST와 ALT는 모두 아민기 전이효소의 일종으로, 간, 비장 등의 세포에 분포하고 있는데, 어체가 건강할 때는 혈중의 활성이 낮다가 스트레스 및 병적증상으로 인해 조직의 괴사가 일어날 때 세포 외로 방출되어 혈중 활성도가 높아지게 된다 (Akbary et al. 2018). 스트레스 연구는 대부분 혈액 내 호르몬 (cortisol) 수치 변화로 어류의 스트레스를 확인하는 보편적인 방법으로 활용되고 있다. 또한, 수온 스트레스 외에 마취제, 질산, 아질산염, 진동 및 염분등에서 혈액성상 및 호르몬 변화에 관한 연구가 있다 (Park et al. 1999, Hur 2002, Lankford et al. 2003, Davis 2004, Hur et al. 2008, Yeon et al. 2011, Jaxion-Harm and Ladich 2014, Cho et al. 2015, Amin and Khan 2016, Hur 2018, Lim and Hur 2018, Hur et al. 2019).
잉어 (Cyprinus carpio)와 붕어 (Carassius auratus)는 우리나라 전역에 걸쳐 서식하고, 겨울철 수온이 낮을 때는 먹이활동을 하지 않으며, 봄이 되어 15°C 이상 수온에서 활발한 활동을 한다 (Kim 1974, Lee et al. 1989). 겨울철 먹이공급이 활발하지 못한 상태에서 수온이 상승하는 봄부터 여름 사이에 이 두 종의 어류는 하천에서 빈번하게 폐사하는 것으로 보고되고 있다 (Lee et al. 1989, Byun et al. 2011). 그러나 아직까지 이 두 종을 포함한 하천에 서식하는 어류가 폐사하는 원인을 구체적으로 판정할 수 없어 많은 수환경 관리에 있어 환경 문제로 대두되고 있다. 아직까지 자연생태계에 서식하는 어류의 생리적 및 폐사 등에 대한 연구가 많지 않다. 잉어와 붕어의 사육과정 중 발생가능한 스트레스 (수온, handling 및 화학약품 노출 등)로 인한 생리적 반응 및 성장에 대한 연구는 보고되고 있다 (Li et al. 2008, Rapp et al. 2012, Liew et al. 2013, Jaxion-Harm and Ladich 2014, Amin and Khan 2016, Sula and Aliko 2017, Wei et al. 2019).
수온의 급격한 변화는 서식하는 어류의 양식과정에서는 인위적으로 일정하게 수온을 조절하여 어류에 스트레스로 작용하지 않지만, 하천 및 호소 등에 서식하는 어류는 수온의 자연적인 일변화 및 특정지역에서 발생할 수 있는 수온 변화가 나타날 수 있어, 서식하는 어류에 생리학적 변화 및 폐사에 영향을 줄 수 있다 (Kibria 2014). 따라서, 한국 하천에서 주요 서식어종인 잉어와 붕어를 대상으로 급격한 수온 변화에 따른 혈액 및 생리학적 변화를 조사하고자 본 연구를 수행하였으며, 이 자료를 기초로 하여 하천에 서식하는 어류의 생리조절 차원에서 어류의 스트레스를 진단할 수 있는 생리지표를 마련하고 하천 수생태계 건강성 및 어류폐사 징후를 예측하여 어류 폐사에 대응하기 위한 기초 자료를 제공하고자 한다.
2. 재료 및 방법
2.1 실험어 및 사육 관리
충청북도 진천군에 위치한 양식장으로부터 잉어 (평균 체장: 13.4±3.97 cm; 평균 체중: 97.1±35.81 g) 및 붕어 (평균 체장: 12.6±2.44 cm; 평균 체중: 84.5±21.45 g) 각 600마리씩 구입하여 군산대학교 양어장에서 1,100 L 수조당 200마리씩 6개의 수조에 14일동안 순화하였다. 사육 수온은 20.0±0.42°C로 유지하였으며, 광주기는 12 L/12 D, pH는 6.9±0.27, 암모늄 이온 (NH4+)은 0.02 mg/L이하, 아질산염 (NO2-) 및 질산염 (NO3-)은 0.01 mg/L 이하 및 1.8±0.14 mg/L로 유지하였다.
2.2 실험구 설정 및 수온조절
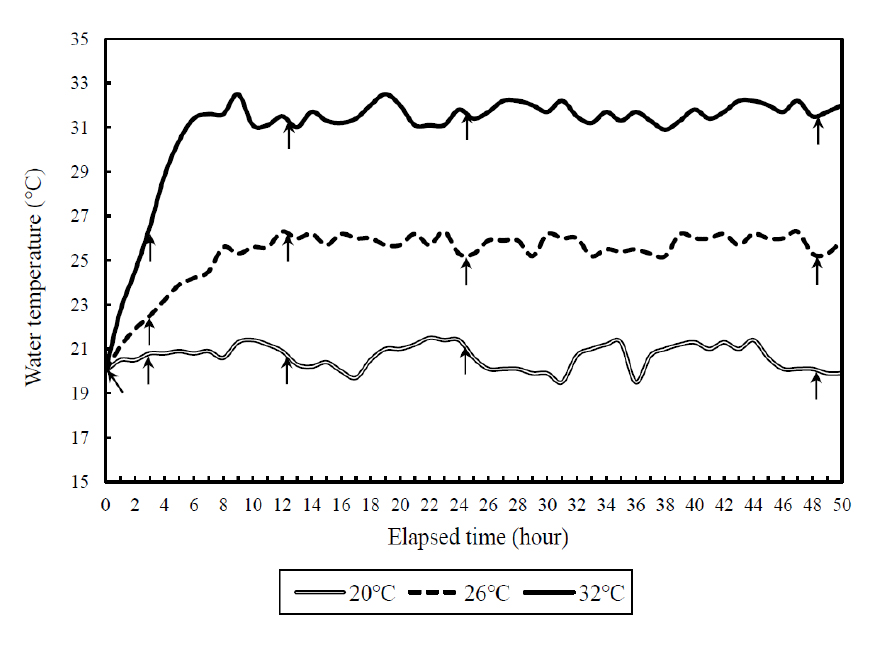
실험 시작 전에 각 실험군별로 잉어와 붕어 20마리를 각각 선별하여 헤파린 처리된 주사기 (3 ml)를 사용하여 미병부의 혈관에서 1분 이내에 채혈하였다. 채혈한 샘플은 1.5 ml microtube에 분주하여 원심분리 (10,000 rpm, 5분)하여 혈장을 추출한 뒤, defreezer (-80°C)에 보관하였다. 순환여과식 사육시스템에서 수온상승 방법은 수온을 상승시키기 전 실험구의 수온은 20°C에서 각각 26°C (시간당 1°C 상승) 및 32°C (시간당 2°C 상승)에 6시간이내에 도달하도록 히터를 설치하여, 수온을 상승시켰다. 각각의 수온에 도달한 이후 26°C 및 32°C로 일정하게 유지하도록 하였으며, 대조구는 실험기간동안 20°C를 유지하였다 (Fig. 1). 각 어종마다 실험 수온별로 총3개의 수조 (가로 및 세로: 90 cm; 높이: 75 cm)를 배정하였고, 수조당 30마리의 실험어류를 각각 수용하였다. 총 18개의 수조 중에 12개의 수조에서는 코티졸 호르몬 측정을 위한 채혈을 실시하였으며, 나머지 6개의 수조는 생존율 측정에 사용하였다.
2.3 생존율 및 혈액분석
생존율은 실험 시작 후 3, 12, 24, 36 및 48시간마다 사망개체수를 계수하여 분석하였다. 채혈시간은 실험 시작 후 3, 12, 24 및 48시간마다 각 실험수온별로 6마리씩 채혈하였으며, 외적인 스트레스를 최소화하기 위해 즉시 채혈을 실시하였다. 채혈은 마취 없이 미병부의 혈관에서 혈액 1 - 3 ml를 채집하였으며, 채집한 혈액의 1 - 2 ml 가량을 분주하여 2,000 g에 5분간 원심분리하여 혈장을 분리하였다. 채혈한 개체는 체장 및 체중을 계측하였으며, 계측한 샘플은 중복 채혈을 예방하기 위해 실험에 사용하지 않는 어류 예비 축장수조에 수용하였다.
채혈한 혈액샘플로부터 혈액성분 및 전해질 분석을 실시하였으며, 분리한 혈장샘플로부터 호르몬 및 혈장성분 분석을 실시하였다. 혈액분석 항목은 스트레스 반응 측정에 필요한 혈액학적 및 삼투압조절 지표 항목을 참고하고 혈액 안정값 설정을 위해 Na+, K+, Cl-, 적혈구 수 (red blood cell), 헤모글로빈 및 헤마토크리트를 조사하였다. 혈액분석 항목 중 적혈구 수, 헤모글로빈 및 헤마토크리트는 자동 혈액 분석기 (BC-2800VET, U.S.A.)로 측정하였으며, Na+, K+ 및 Cl-와 같은 혈액내 전해질 성분은 자동 전해질 분석기 (i-Smart 30 VET, U.S.A.)로 측정하였다. 호르몬 및 혈장성분 분석 항목은 스트레스 반응 요인별 측정 대상 지표 중 내분비학 및 대사학적 지표에 해당되는 코티졸, 글루코스, aspartate aminootransferase (AST) 및 alanine aminotransferase (ALT)을 조사하였다. 코티졸은 Cortisol analyse kit (Fuji Film, Japan)를 이용하여 호르몬 분석 기기 (DRI-CHEM, Fuji Film, Japan)로 분석하였다. 글루코스, AST 및 ALT은 혈장성분 분석기기 (DRI-CHEM NX500i, Fuji Film, Japan)를 이용하여 분석하였다.
2.4 통계처리
각 실험수온별 혈액성상 반응, 코티졸, 글루코스, AST 및 ALT 농도의 유의성 분석은 One-way ANOVA 및 Duncan’s multiple range test로 다중검정을 진행하였다 (P< 0.05).
3. 결 과
3.1 혈액성상 반응 (Hematological response)
본 연구에서 수온 스트레스에 의해 사망한 잉어와 붕어 개체는 모든 실험구에서 나타나지 않았다. 잉어의 Na+ 농도는 48시간동안 각각 133.7 - 138.6 (20°C), 133.7 - 140.7 (26°C) 및 133.7 - 146.5 mEq/l (32°C)의 범위로 변화하였으며, K+ 농도는 48시간동안 각각 1.6 - 1.8 (20°C), 1.8 - 2.3 (26°C) 및 1.8 - 2.4 mEq/l (32°C)의 범위로 변화하였다 (P<0.05, Table 1). Cl-농도는 48시간동안 각각 108.5 - 111.6 (20°C), 108.5 - 111.7 (26°C) 및 108.5 - 114.0 mEq/l (32°C)의 범위로 변하였으며, 잉어의 Na+, K+ 및 Cl-농도는 32°C에서 변화폭이 가장 컸다. 각 실험수온별 실험구의 적혈구 수는 대조구를 포함한 모든 실험구에서 시간이 경과함에 따라 증가하였다가 감소하였으나 48시간 이후의 결과값이 실험 전의 결과값 (0시간)에 비해 유의적으로 높게 나타났다. 48시간동안 0.8에서 1.8 (20 및 26°C) 및 1.7×106 cell/µl (32°C)로 증가하다가 1.3 (20 및 26°C) 및 1.1×106 cell/µl (32°C)로 감소하였다. 헤모글로빈 수치는 각각 8.6에서 15.5 (20°C), 16.0 (26°C) 및 13.1 g/dL (32°C)로 증가하다가 11.8 (20 및 32°C) 및 13.0 g/dL (26°C)로 감소하였다. 또한, 헤마토크리트 수치도 각각 15.1에서 32.1 (20°C), 33.1 (26°C) 및 30.6% (32°C)로 증가하다가 24.5 (20°C), 23.3 (26°C) 및 24.3% (32°C)로 감소하였다 (Table 2).
Table 1.
Variations of Na+, K+ and Cl– in common carp (Cyprinus capio) and crucian carp (Carassius auratus) on each water temperature
Table 2.
Variations of hematocrit, hemoglobin and red blood cell in common carp (Cyprinus capio) and crucian carp (Carassius auratus) on each water temperature
각 실험수온별 붕어의 Na+ 농도는 48시간동안 각각 133.8 - 136.7 (20°C) 및 133.8 - 139.0 mEq/l (26 및 32°C)의 범위로 측정되었으며, K+ 농도는 48시간동안 각각 1.6 - 2.1 (20°C), 1.8 - 2.3 (26°C) 및 1.6 - 3.0 mEq/l의 범위로 측정되었다 (Table 1). Cl-농도는 48시간동안 각각 105.6 - 109.3 (20°C), 105.6 - 110.7 (26°C) 및 105.6 - 114.1 mEq/l의 범위로 측정되었으며, 붕어의 Na+, K+ 및 Cl-농도는 32°C에서 변동폭이 가장 컸다. 각 실험수온별 실험구의 적혈구 수는 48시간동안 0.9에서 0.6×106 cell/µl로 감소하였다. 헤모글로빈 수치는 8.7에서 9.1 (20°C), 9.3 (26°C) 및 9.4 g/dL (32°C)로 증가하다가 실험 시작 후 48시간에는 7.2 (20°C), 7.8 (26°C) 및 8.2 g/dL (32°C)로 감소하였다. 또한, 헤마토크리트 수치도 각각 12.6에서 14.3 (20°C), 14.0 (26°C) 및 13.7% (32°C)로 증가하다가 실험 시작 후 48시간에 11.1 (20°C), 11.3 (26°C) 및 12.5% (32°C)로 감소하였다 (Table 2). 잉어와 붕어의 Na+, K+ 및 Cl-농도는 실험수온이 증가할수록 증가한 반면, 적혈구 수, 헤모글로빈 및 헤마토크리트 수치는 실험수온이 증가할수록 감소하였다.
3.2 호르몬 반응 (Hormonal response)
잉어 20°C 대조구의 코티졸 농도는 48시간동안 2.1 - 4.8 µg/dL의 범위로 다른 실험구에 비해 현저히 낮은 수치로 측정되었다. 잉어 26°C 실험구는 실험 시작 후 3시간에 26.8±1.4 µg/dL로 증가하다가 (P<0.05), 24시간에 2.7±1.1 µg/dL로 감소하였다 (Fig. 2). 잉어 32°C 실험구도 실험 시작 후 코티졸 농도가 지속적으로 증가하여 12시간에 51.5±1.9 µg/dL로 가장 높은 코티졸 농도가 측정되었으며 (P<0.05), 이후 24시간에 3.4±0.3 µg/dL로 감소하였다. 붕어 20°C 대조구의 코티졸 농도는 48시간동안 2.6 - 4.9 µg/dL의 범위로 다른 실험구에 비해 현저히 낮은 수치로 측정되었다. 붕어 26°C 실험구는 실험 시작 후 24시간에 52.6±2.3 µg/dL로 증가하다가 48시간에 42.6±2.3 µg/dL로 감소하였으나 (P>0.05) 실험 전의 코티졸 농도에 비해 높게 나타났다 (P<0.05, Fig. 2). 붕어 32°C 실험구의 코티졸 농도가 실험 시작 후 24시간에 54.4±1.6 µg/dL로 증가하였고 이후 48시간까지 55.4±0.7 µg/dL로 유지되었다 (P<0.05).
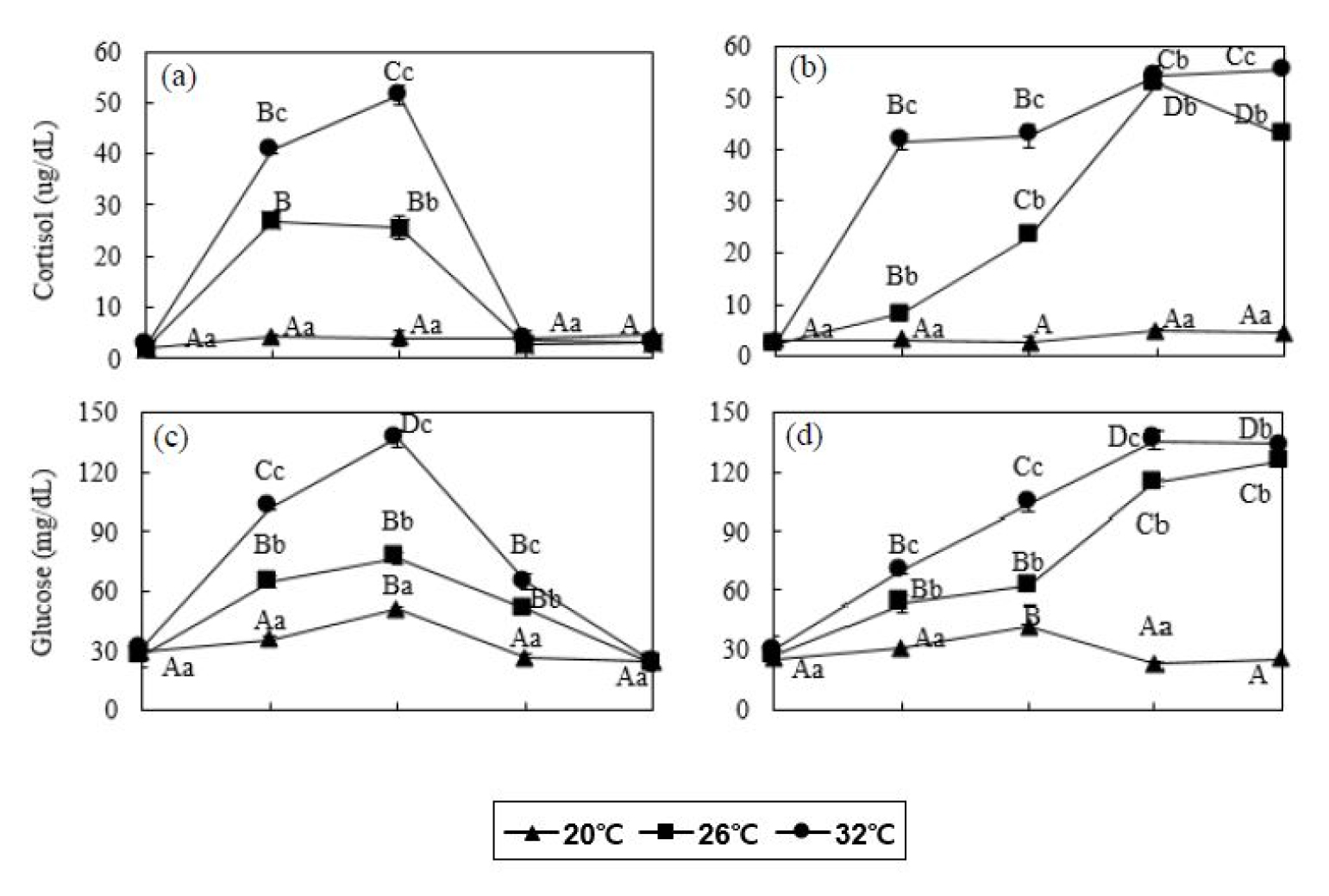
Fig. 2
Plasma cortisol (a and b) and glucose (c and d) concentration of common carp (Cyprinus capio) and crucian carp (Carassius auratus) for 48 hours. Values are means±SD of experiments (n=6). Error bars represent the standard deviation of experiments (P<0.05). Values on error bars not sharing capital letter are significantly different among elapsed time in same experimental groups (P<0.05). Shared alphabetic letters on error bars indicate a lack of significant difference among experimental groups at equivalent times (P>0.05). Capital letters: significance among elapsed time in same water temperature; small letters: significance among water temperature in same elapsed time. Common carp: (a) and (c); crucian carp: (b) and (d).
잉어 20°C 대조구의 글루코스 농도는 48시간동안 29.0 - 50.0 mg/dL의 범위로 다른 실험구에 비해 현저히 낮은 수치로 측정되었다. 잉어 26°C 실험구는 실험 3시간후에 76.3±3.1 mg/dL로 증가한 후 일정하게 유지되었으며, 48시간에 23.7±2.9 mg/dL로 감소하였다 (P<0.05, Fig. 2). 잉어 32°C 실험구의 글루코스 농도도 실험 시작 후 12시간까지 137.0±4.6 mg/dL로 증가하였고 이후 계속 감소하여 48시간 후에는 24.0±4.4 mg/dL를 나타내었다 (P<0.05). 붕어 20°C 대조구의 글루코스 농도는 48시간동안 23.3 - 42.0 mg/dL의 범위로 다른 실험구에 비해 현저히 낮은 수치로 측정되었다. 26 및 32°C 실험구는 실험 시작 후 48시간까지 125.7±2.1 및 134.3±4.5 mg/dL로 증가하였다 (P<0.05, Fig. 2).
잉어 20°C 대조구의 AST 농도는 48시간동안 32.7 - 35.3 IU/L의 범위로 다른 실험구에 비해 현저히 낮은 수치로 측정되었다. 잉어 26 및 32°C 실험구는 실험 시작 후 3시간에 170.3±1.5 및 188.0±1.0 IU/L로 각각 증가하였으며, 이후 계속 감소하여 48시간 후에는 68.0±3.0 및 103.7±2.3 IU/L로 감소하였다 (P<0.05, Fig. 3). 붕어 20°C 대조구의 AST 농도는 48시간동안 27.7 - 32.7 IU/L의 범위로 다른 실험구에 비해 현저히 낮은 수치로 측정되었다. 붕어 26 및 32°C 실험구는 실험 시작 후 3시간에 228.3±18.5 및 304.7±10.0 IU/L로 각각 증가하였으며, 이후 계속 감소하여 48시간 후에 96.7±6.7 및 149.7±8.5 IU/L로 각각 감소하였으나 실험 전의 농도에 비해 높은 수준이었다 (P<0.05, Fig. 3).
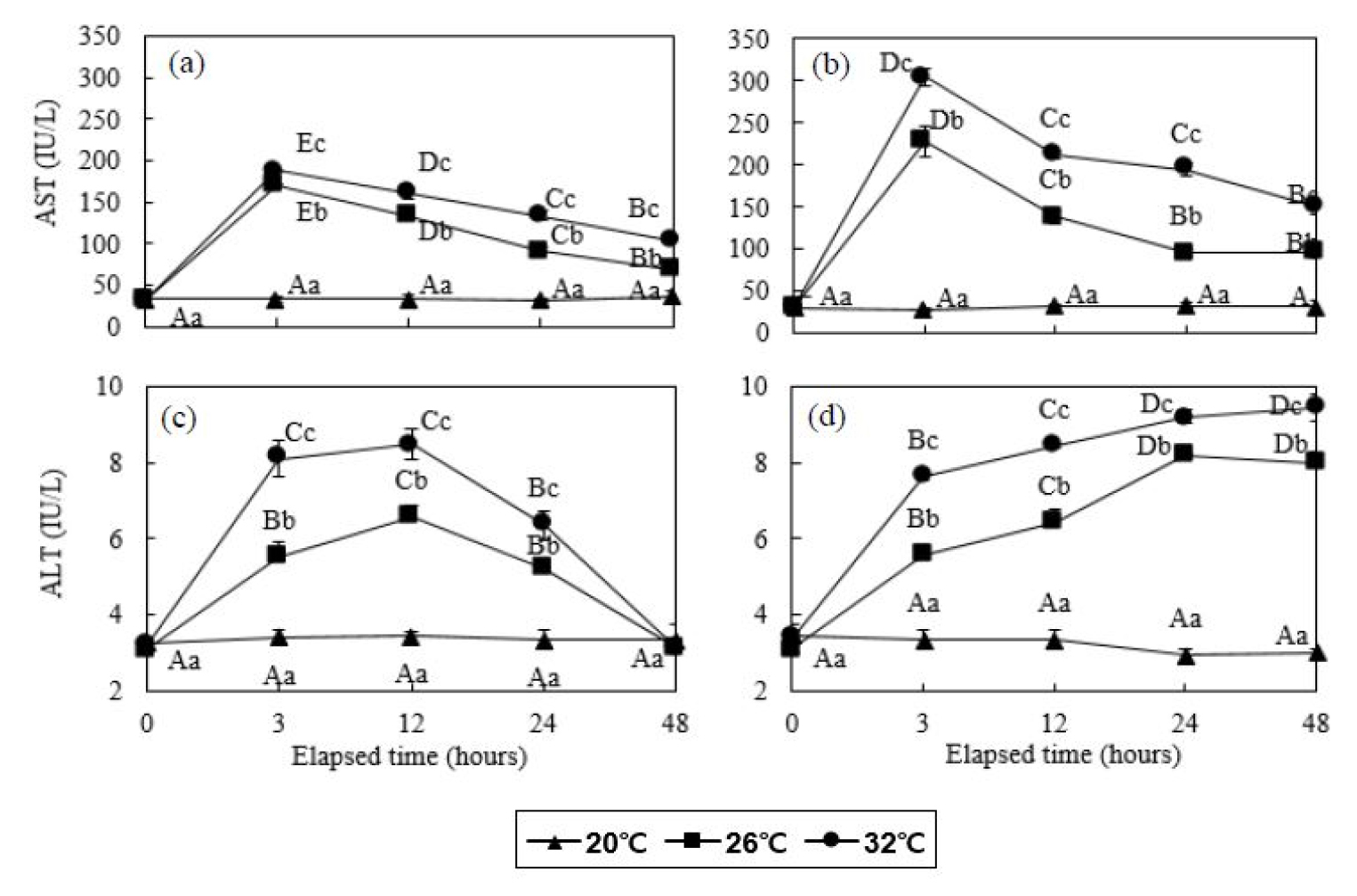
Fig. 3
Aspartate aminotransferase (AST, a and b) and alanine aminotransferase (ALT, c and d) concentration of common carp (Cyprinus capio) and crucian carp (Carassius auratus) for 48 hours. Values are means±SD of experiments (n=6). Error bars represent the standard deviation of experiments (P<0.05). Values on error bars not sharing capital letter are significantly different among elapsed time in same experimental groups (P<0.05). Shared alphabetic letters on error bars indicate a lack of significant difference among experimental groups at equivalent times (P>0.05). Capital letters: significance among elapsed time in same water temperature; small letters: significance among water temperature in same elapsed time. Common carp: (a) and (c); crucian carp: (b) and (d).
잉어 20°C 대조구의 ALT 농도는 48시간동안 3.2 - 3.4 IU/L의 범위로 다른 실험구에 비해 현저히 낮은 수치로 측정되었다. 잉어 26 및 32°C 실험구는 실험 시작 후 12시간까지 6.6±0.3 및 8.5±0.5 IU/L로 증가하였으며, 이후 48시간까지 3.1±0.2 및 3.1±0.1 IU/L까지 감소하였다 (P<0.05, Fig. 3). 붕어 20°C 실험구의 ALT 농도는 48시간동안 2.9 - 3.4 IU/L의 범위로 다른 실험구에 비해 현저히 낮은 수치로 측정되었다. 붕어 26 및 32°C 실험구는 실험 시작 후 48시간까지 8.2±0.1 및 9.4±0.4 IU/L까지 지속적으로 증가하였다 (P<0.05, Fig. 3).
4. 고 찰
수온 변화는 환경스트레스 요인 중 하나로 어류의 생리학적 반응 성장에 직접적으로 영향을 주는 것으로 알려져 있다 (Elliott 1982, Barton and Iwama 1991, Dutta 1994, Bhikajee and Gobin 1998, Hur et al. 2008, Lee et al. 2014, Shin et al. 2018). 특히, 수온의 급격한 변화로 인해 어류의 물질대사 및 혈액성상 반응이 변한다고 이전 연구를 통해 보고된 바 있다 (Lankford et al. 2003, Takahara et al. 2011, Jaxion-Harm and Ladich 2014, Amin and Khan 2016). Lankford et al. (2003)은 green sturgeon, Acipenser medirostris를 대상으로 수온이 11°C 및 19°C인 사육수조에서 각각 공기에 1분간 노출된 후에 3시간동안 스트레스 호르몬 변화를 조사하였다. 공기노출 스트레스를 받고 20분 후의 코티졸 농도는 각각 138.1 ng/ml (11°C) 및 201.2 ng/ml (19°C)로 가장 높게 나타났고, 3시간 후의 코티졸 농도는 각각 35.8 ng/ml (11°C) 및 56.7 ng/ml (19°C)로 감소하였다. 수온이 높을수록 코티졸의 농도가 증가하는 경향이 나타났다. 11°C 및 19°C 실험군의 글루코스 농도는 공기노출 스트레스 받은 이후부터 3시간동안 지속적으로 증가하는 경향이 나타났으며, 수온이 높을수록 글루코스의 농도는 감소하는 경향이 나타났다. 이러한 결과를 토대로 Acipenser medirostris가 고수온 환경에서는 스트레스에 대한 반응이 민감하며, 그로 인해 에너지 소비가 증가하였다고 보고하였다.
Balta et al. (2017)은 black sea trout (Salmo trutta)를 대상으로 수온의 급격한 변화에 따른 생리학적 변화를 조사하였다. 사육수온을 25°C에서 15°C로 10분동안 감소시키자 (1°C/min), 코티졸 농도가 수온변화 후 1시간에 1.07±0.24 µg/dL에서 30.19±1.17 µg/dL으로 증가하였고 수온변화 후 3시간에 10.69±2.66 µg/dL로 감소하였다. 이후 72시간까지 대조군과 유의한 차이가 나타나지 않은 낮은 농도를 유지하였다. 글루코스 농도는 수온변화 후 1시간에 12.8±1.20 mg/dL에서 62.0±3.03 mg/dL로 급격히 증가하였고 이후 48시간동안 지속적으로 감소하여, 수온변화 후 72시간에 대조군과 유의한 차이가 나타나지 않은 농도로 회복하였다. Na+, K+ 및 Cl- 농도도 수온변화 후 1시간에 증가하여 이후 72시간까지 지속적으로 감소하는 경향이 나타났다. 이러한 결과를 토대로 black sea trout가 수온변화 스트레스를 72시간내에 회복하였다고 보고하였다.
Takahara et al. (2011)은 일본 비와호에 서식하는 잉어를 포획하여 12시간동안 양식장에 순치한 다음, 4일간 사육수온을 자연수온과 동일한 22°C를 유지하다가, 실험 5일째에 사육수온을 22°C에서 25°C로 증가시켰다. 그 결과, 실험 전의 handling stress로 인해 증가했던 코티졸 농도가 4일간 감소하다가 수온이 증가한 5일에 1.0 ng/L에서 2.91 ng/L로 증가하였다. 또한, 코티졸 증가율 (cortisol release rate, ng/g·hour)도 4일간 2.8 ng/g·hour에서 1.2 ng/g·hour로 감소하다가 5일에 3.84 ng/g·hour로 급격하게 증가하였다고 보고한 바 있다.
Jaxion-Harm and Ladich (2014)는 사육수온의 변화에 따른 잉어의 코티졸 농도 변화를 조사하였다. 20°C에서 사육된 잉어의 코티졸 농도가 0.601±0.102 ng/L water·g fish로 나타났으며, 사육수온을 14°C로 낮추었을 때 0.012±0.004 ng/L water·g fish로 감소하였다. 14°C와 20°C를 1시간 간격으로 번갈아서 180번 노출시킨 잉어의 코티졸 농도도 0.301±0.060 ng/L water·g fish으로 감소하였다. Jaxion-Harm and Ladich (2014)의 연구에서는 잉어의 사육수온이 14°C일 때, 사육수온에 대한 스트레스를 최소화할 수 있다고 보고하였다.
Amin and Khan (2016)은 수온의 변화에 따른 잉어의 혈액성상 반응에 대하여 보고하였다. 잉어의 사육수온이 25°C에서 15°C로 감소할 경우, 적혈구 수는 138.5±3.31×104 cell/mm3에서 136.0±1.9×104 cell/mm3로 감소하였으나 헤마토크리트 및 헤모글로빈 수치는 유의한 차이가 없었다. 수온이 25°C에서 32 및 38°C로 각각 증가할 경우, 적혈구 수는 각각 144.0±2.23×104 cell/mm3 및 146.0±5.43×104 cell/mm3으로 각각 증가하였으며, 38°C에서의 헤모글로빈 수치도 7.9±0.7 g/dl에서 9.0±0.5 g/dl로 증가하였다. 본 연구에서는 잉어의 Na+, K+ 및 Cl- 농도는 실험수온이 높을수록 증가하는 경향이 나타났으며, 고수온 스트레스에 따른 혈액내 Na+ 이온의 변화폭이 K+ 및 Cl-이온의 변화폭에 비해 더 크게 나타났다. 고수온 스트레스에 따른 잉어의 혈액성상 반응은 경과시간이 지남에 따라 증가하다가 감소하는 경향이 모든 실험구에서 공통적으로 나타났으며, 26°C 실험구에서 적혈구 수, 헤모글로빈 및 헤마토크리트 수치가 가장 높게 증가하였다. 붕어의 Na+, K+ 및 Cl- 농도도 실험수온이 높을수록 증가하는 경향이 나타났고, 고수온 스트레스에 따른 붕어의 혈액성상 반응은 시간이 경과되면서 증가하다가 감소하는 경향이 모든 실험구에서 공통적으로 나타났으며, 수온이 높을수록 각 혈액성상 분석항목의 수치가 증가하는 경향이 잉어와 붕어에서 모두 나타났다. 대조구의 헤마토크리트 증가는 붕어의 경우 실험종료시 실험개시시와 유의한 차이는 없었으나, 잉어의 경우 높은 값으로 남아있었는 데 이는 포획시 핸들링 스트레스로 판단되어 진다.
앞서 서술한 이전 연구들에서는 어류가 수온을 비롯한 스트레스에 지속적으로 노출될 경우, 혈액성상 반응, 코티졸 및 글루코스와 같은 스트레스 호르몬 농도가 급격히 증가한 다음에 유지되거나 천천히 감소하는 공통된 경향이 나타났다. 본 연구의 결과에서도 잉어의 스트레스 호르몬 농도는 증가하다가 다시 스트레스반응 이전의 농도로 회복되었다. 또한, 적정수온범위 내의 변화 (20 및 26°C)에서는 잉어의 스트레스 호르몬 농도가 증가하다가 실험 시작 후 24시간에 스트레스반응 이전의 농도로 회복되는 경향도 나타났다. 그러나 붕어도 적정수온범위 이상의 수온(26 및 32°C)에 노출되었을 때, 코티졸 및 글루코스 농도가 증가한 후에 감소하지 않고 유지되는 경향이 유사하게 나타났다. Jaxion-Harm and Ladich (2014)를 비롯한 이전 연구에서는 어류가 환경변화로 인한 스트레스에 노출되어 코티졸과 glucose 농도가 증가하다가, 일정시간 (12 - 48시간) 이내에 실험 이전 (대조군) 수준으로 회복한다면 어류가 해당 환경변화에 적응하였거나 스트레스 노출 이전의 수준으로 생리대사를 회복한 것이라고 제안하였다. 이전 연구와 본 연구의 결과를 종합하면 수온변화가 잉어 및 붕어에 스트레스를 유발시켰으며, 잉어는 24시간 이내에 실험수온에 적응하였으나, 붕어는 48시간 이내에 실험수온에 적응하지 못했거나 적응에 48시간 이상이 소요될 것으로 추측할 수 있다. 그리고 Penghan et al. (2014)은 수온의 변화에 따른 붕어의 유영속도 및 활동대사율 변화를 분석하였는데, 수온이 20°C에서 10°C로 감소하면 붕어의 유영속도가 유의하게 감소하였고, 활동대사율도 48% 감소하였다고 보고하였는데 차후 연구에서는 수온의 증가에 따른 잉어 및 붕어의 유영속도 및 활동대사율 변화를 조사할 필요가 있다.
수온외 여타 스트레스에서도 코티졸 및 글루코스의 농도 변화가 유사한 경향으로 나타났다. Sula and Aliko (2017)는 스트레스 요인에 의한 붕어의 코티졸 및 글루코스 농도 변화에 대해 연구한 결과, 스트레스에 노출된 붕어의 코티졸 (124.6±42.7 ng/ml) 및 글루코스 (366±96 mg/dl) 농도가 정상적인 붕어의 코티졸 (45±1.4 ng/ml) 및 글루코스 (75±10 mg/dl)에 비해 높게 나타났다고 보고하였다. 또한, Rapp et al. (2012)는 잉어의 포획 및 수용에 따른 혈액 및 생리학적 변화를 연구하였는데 포획 및 수용 후 9시간동안 코티졸 농도가 지속적으로 증가하였다고 보고하였다. 또한, AST 농도도 9시간동안 지속적으로 증가하였다. 이러한 변화는 잉어의 포획 및 수용으로 인해 유발된 스트레스가 근육 등의 세포 손상과 이를 복구하기 위한 간, 비장 등 기관의 효소활동 및 에너지 사용이 원인이라고 제안하였다. 본 연구에서는 잉어가 수온변화에 노출시 AST 및 ALT 농도가 증가하다가 실험 시작 후 48시간에 회복하였으나 붕어의 AST 및 ALT 농도는 실험기간동안 높은 농도를 유지하였다. 본 연구와 Rapp et al. (2012)의 결과를 토대로, 잉어는 수온 변화에 노출시 시간이 경과하면서 손상된 세포의 복구에 필요한 효소활동 및 에너지 사용이 증가하였다가 원상태로 회복되었으나 붕어는 수온 변화로 인해 손상된 세포를 복구하는 효소활동 및 에너지 사용이 지속적으로 증가한 것으로 추측할 수 있다.
Wei et al. (2019)는 빛의 세기에 따른 붕어의 코티졸, 글루코스 및 헤마토크리트 변화에 대해 보고하였다. 노출되는 빛의 양이 증가할수록 코티졸 및 글루코스 농도가 빛에 노출되기 이전보다 증가하였으며, 헤마토크리트 수치는 빛의 세기에 따른 변화가 나타나지 않았다. 9.46 µmol/m2s의 빛에 노출된 경우, 코티졸 농도는 120.19±18.94 ng/ml로 가장 높게 나타났으며, 1.08 µmol/m2s의 빛에 노출되었을 때, 코티졸 농도가 69.54±8.31 ng/ml로 대조군을 포함한 모든 실험군 중에서 가장 낮게 나타났다. Li et al. (2008)은 붕어가 microcystin에 노출시 호흡수, thyroid 및 cortisol 호르몬의 변화에 대해 연구하였다. 150 및 600 µg/kg의 microcystin에 각각 노출시 노출 후 1시간부터 코티졸 호르몬의 농도가 급격하게 증가하였으며, 노출 후 48시간까지 유지되는 경향이 나타났으며, microcystin의 농도가 증가할수록 코티졸 농도도 증가하였다 (Li et al. 2008).
Liew et al. (2013)은 잉어 및 붕어가 사료공급에 따른 혈액성상 반응 및 코티졸 호르몬 농도의 변화에 대해 연구한 바 있다. 붕어는 7일간 사료를 공급하지 않았을 때 (기아군, Starved group), 혈장내 Cl이온 농도가 7일간 사료를 공급한 실험군 (급이군, Fed group)보다 증가하였다. 기아군의 K+이온 농도도 급이군에 비해 증가하였으며, 잉어 기아군의 Na+, K+ 및 Cl- 이온 농도도 급이군에 비해 증가하였다. 또한, 붕어 및 잉어에게 7일간 사료를 공급하지 않았을 때, 코티졸 농도가 증가하였다고 보고한 바 있다. Yeon et al. (2011)의 연구에서는 잉어를 대상으로 건설장비 가동시 발생되는 소음 및 진동으로 인한 스트레스 호르몬 변화를 조사하였다. 상온에서 35일간 매일 스트레스 자극을 9시간 동안 진동 (80 dB) 및 소음 (123 dB)을 가하였을 때, 성장 및 코티졸 변화를 분석한 결과, 성장률, 사료효율 및 코티졸 농도가 대조군과 실험군간 유의성이 검정되지 않았다. 이러한 결과를 통해 수중에서 발생한 소음과 진동이 잉어에게 스트레스로 작용하지 않았다고 보고하였다.
본 연구와 비교하였을 때, 잉어와 붕어는 스트레스 요인에 따라 코티졸 및 글루코스의 농도 변화, 스트레스 반응시간이나 회복속도가 다르다는 사실도 도출할 수 있었다. 차후 연구에는 수온을 비롯한 여타 스트레스 요인에 장기간 노출시 혈액성상 반응, 스트레스관련 호르몬과 더불어 유영속도 및 활동대사율의 변화, 간, 신장과 같은 조직의 손상을 조사하여 어류가 스트레스에 노출시 생리학적 반응을 명확하게 구명해야 할 것이다.
5. 결 론
잉어 (Cyprinus carpio)와 붕어 (Carassius auratus)는 우리나라 전역에 걸쳐 서식하고, 겨울철 수온이 낮을 때는 먹이활동을 하지 않으며, 봄이 되어 15°C 이상 수온에서 활발한 활동을 한다. 겨울철 먹이공급이 활발하지 못한 상태에서 수온이 상승하는 봄부터 여름 사이에 이 두 종의 어류는 하천에서 빈번하게 폐사하는 것으로 보고되고 있으나 아직까지 폐사하는 원인을 구체적으로 판정할 수 없어 많은 수환경 관리에 있어 환경 문제로 대두되고 있다. 따라서, 국내 하천에서 주요 서식어종인 잉어와 붕어를 대상으로 급격한 수온 변화에 따른 혈액 및 생리학적 변화를 조사하고자 본 연구를 수행하였으며, 이 자료를 기초로 하여 하천에 서식하는 어류의 생리조절 차원에서 어류의 스트레스를 진단할 수 있는 생리지표를 마련하고 하천 수생태계 건강성 및 어류폐사 징후를 예측하여 어류 폐사에 대응하기 위한 기초 자료를 제공하고자 한다.
1) 수온 32°C로 상승한 붕어 실험구의 경우, 수온상승 후 3시간에 코티졸, 글루코스, Aspartate aminootransferase (AST) 및 Alanine aminotransferase (ALT) 농도가 증가하였으며, 48시간까지 농도가 감소하지 않았다.
2) 수온 32°C로 상승한 실험구의 잉어와 붕어의 Na+, K+ 및 Cl- 농도는 20 및 26°C 실험군에 비해 높게 나타났다. 대조구를 포함한 모든 실험구의 혈액성상 반응은 잉어와 붕어 모두에서 수온상승 후 12시간까지 증가하다가 수온상승 후 48시간째에 감소하는 경향이 공통적으로 나타났다.
3) 본 연구로 도출된 결과를 이용하여 어류가 스트레스에 노출시 생리학적 반응을 명확하게 구명할 수 있는 방안으로 활용 가능할 것이다. 또한 최근 하천 및 호소에서 어류 폐사가 빈번하게 발생되고 있어서 이에 대한 기초자료로 활용할 수 있을 것으로 판단된다.