1. 서 론
2. 재료 및 방법
2.1 Camelina 생육 조건 및 처리
2.2 뿌리 신장 측정 및 Hematoxylin 염색
2.3 qRT-PCR 분석
2.4 Xanthan gum과 Al 결합 분석
2.5 Morin 염색 및 Al 함량 분석
2.6 통계 분석
3. 결과
3.1 Xanthan gum 및 Al 처리에 따른 Camelina 뿌리 생장 비교
3.2 Xanthan gum 처리에 따른 Camelina 뿌리 생장
3.3 Xanthan gum 혼합 유무에 따른 ALMT1 유전자 발현 조사
3.4 Xanthan gum의 Al 이온 결합 분석
3.5 Xanthan gum 혼합 유무에 따른 Camelina 뿌리의 Al 축적 비교
4. 고 찰
5. 결 론
1. 서 론
지구온난화가 진행됨에 따라 이상기후로 인한 홍수가 증가하였다. 이러한 홍수피해를 막기 위해 제방의 강도 증진이 필요하다. 기존에 제방들은 콘크리트 구조물을 이용하여 건설하였으나, 최근 콘크리트 구조물에 의한 독성과 환경 파괴가 대두되면서 친환경 제방 건설이 요구되고 있으며, 그중 식물들을 이용하여 제방의 강도 증진 방법이 연구되고 있으나 (Hamidifar et al. 2018), 식물이 제방에 활착하기 전까지 강도가 매우 약하다는 단점이 있다. 그러나 최근 연구에서 xanthan gum을 토양에 혼합하면 xanthan gum과 토양 입자간의 수소결합을 통해 토양 강도의 증진 효과가 보고되었다 (Chang et al. 2015). 하지만 제방 토양에 xanthan gum이 혼합되었을 때 주변 식물에 미치는 영향에 대한 연구는 부족한 실정이다. 또한 제방은 하천에 의해 여러 물질들이 혼입될 수 있는 지형으로, 제방에 자생하고 있는 식물들은 여러 스트레스에 노출될 가능성이 있으므로, 환경스트레스 조건에서 xanthan gum 혼합 토양이 식물에 미치는 연구가 필요하다. 최근 연구에서 xanthan gum을 혼합한 토양에서 식물의 가뭄 및 Zn 과잉 스트레스 피해를 감소시켜 생장에 긍정적 효과가 있다고 보고되었지만 (Lim et al. 2018, Shin et al. 2020), 고염분 및 토양의 pH와 같은 환경 스트레스 조건에서 식물에 미치는 독성에 대한 평가가 부족하다.
Aluminum (Al)은 지각에 가장 많이 분포 되어있는 금속원소로 대부분 불용성 형태인 알루미늄 규산염 또는 산화물 형태로 존재한다 (Rengel 2004). 하지만 산성 토양에서 Al은 가용성 형태로 바뀌어 식물 뿌리세포의 세포벽 및 원형질막을 파괴하여 뿌리 생장을 억제하고, 성장에 필요한 영양분 및 물의 흡수가 제한되어 식물 생산성에 악영향을 미친다 (Koachian 1995, Zhang et al. 2019, Guo et al. 2020). 식물은 이러한 Al 독성을 방어하기 위해 뿌리로부터 토양으로 유기산을 방출하여 유기산-Al 복합체를 형성하는 무독화 및 일부 뿌리로부터 흡수된 Al을 세포내 액포로 격리시키는 기작이 알려져 있다. 대표적으로 밀에서 발견된 aluminum activated malate transporter 1 (TaALMT1)은 원형질막에 존재하며 malate를 방출하여 Al 내성에 관여한다고 알려져 있다 (Sasaki et al. 2004, Yamaguchi et al. 2005). 또한 Camelina에서 CsALMT1가 과발현되면 Al 내성이 증가하였다 (Park et al. 2017). 이 외에도 원형질막에 존재하는 H+-ATPase의 전사 조절이 Al 과잉 스트레스 조건에서 유기산 방출과 Al 내성에 중요하다고 보고되었다 (Ahn et al. 2004, Shen et al. 2005, Yu et al. 2016). 예를 들어 식물의 H+-ATPase (AHA)는 proton gradient를 조절하여 malate 및 citrate의 방출에 기여한다 (Zhang et al. 2017). 마찬가지로 액포에 존재하는 V-type ATPase도 액포내로의 Al 격리 및 내성 증진에 관여한다고 보고되었다 (Zang et al. 2019).
이전의 연구에서 xanthan gum 및 β-glucan이 토양에 혼합되면 과도한 Zn 스트레스로부터 식물 피해를 경감시키는 효과가 보고된 바 있으며, Al 오염 토양을 바이오폴리머로 개량하여 식물이 활착 가능한 환경으로 바뀌는 연구가 보고되었다 (Larson et al. 2016, Shin et al. 2020). 본 연구에서는 토양에 Al이 과잉으로 존재할 때 xanthan gum이 식물 (Camelina) 뿌리에 미치는 영향을 조사하고자 하였다. 이를 위하여 뿌리 생장 관찰이 용이한 수경 재배환경에서 xanthan gum과 Al을 처리하여 xanthan gum 혼합에 따른 Camelina의 생장을 조사하였으며, 식물의 유전자 수준에서 반응을 관찰하기 위해 Al 스트레스 내성과 관련 있는 ALMT1의 발현을 비교하였다. 추가적으로 xanthan gum과 Al의 결합을 분석하였고, 식물체 내 Al 이온의 함량을 측정하여 식물체내로의 Al 이온의 유입을 비교하였다.
2. 재료 및 방법
2.1 Camelina 생육 조건 및 처리
본 연구에서 사용된 xanthan gum (Santa Cruz Biotechnology, USA)은 Santa Cruz에서 구입하여 실험에 사용하였다. 파종된 Camelina는 22±1°C, 16시간/8시간 (180 μmol m-2 s-1) 광주기의 배양실에서 1/2 Hoagland nutrient solution에 Camelina를 4일간 발아 및 생육하였다. 생육된 Camelina 유묘를 바이오폴리머가 혼합된 1/2 Hoagland nutrient solution (pH 4.3, non-phosphorus)에 이식하여 AlCl3 0 μM 부터 20 μM와 xanthan gum 0.05% (weight/volume)를 처리하여 24시간 생육하였다.
2.2 뿌리 신장 측정 및 Hematoxylin 염색
4일간 생육한 Camelina 뿌리 끝에서 1cm 간격으로 2회 먹물 (indian ink)를 이용하여 선을 그었다. 뿌리의 외부 노출에 의한 건조를 방지하기 위해 1차 증류수가 적셔진 여과지 위에서 실험을 수행하였다. 선을 그은 Camelina를 Al이 처리된 1/2 Hoagland nutrient solution (pH 4.3, non-phosphorus)에 이식 후 6, 12 그리고 24시간에서 뿌리의 생장을 측정하였다.
파종 후 4일된 Camelina 유묘를 10 μM AlCl3 수용액과 xanthan gum 0, 0.01, 0.025 그리고 0.05%를 24시간 처리한 후 증류수에 5분간 세척하였다. 세척한 식물을 상온에서 0.2% hematoxylin 수용액에 식물을 침지하여 10분간 염색시켰으며 15분간 1차 증류수로 염색된 샘플들은 세척 후 현미경을 이용하여 관찰하였다. 염색은 aluminum foil을 이용하여 암조건 상태에서 진행하였다.
2.3 qRT-PCR 분석
10 μM AlCl3 24시간 동안 처리한 Camelina 뿌리를 채취하여 액체질소로 동결시킨 후 샘플을 분쇄하였다. 분쇄된 샘플들의 total RNA를 trizol 추출법을 이용하여 추출하였다 (Macrae 2007). 추출한 total RNA에 DNA-freeTM kit (invitrogen, USA)를 처리하여 DNA를 제거 후 AccuPower ® CycleScript RT PreMix (Bioneer, south korea)를 이용하여 cDNA를 합성하였다. ALMT1과 Actin의 유전자 서열을 기반으로 “Table 1”의 Primer를 제작하여 qRT-PCR을 진행하였다.
2.4 Xanthan gum과 Al 결합 분석
0, 25, 50, 100, 200 μM AlCl3 수용액 500 μl를 0.1 M morin hydrate – methanol용액 300 μl 과 증류수 200 μl 혼합하여 (morin 300 μM, AlCl3 0, 12.5 25, 50, 100 μM) 10분간 상온에서 반응시켰다. 그 후 분광광도계 (libra S60, Biochrom, UK) 418 nm 파장으로 흡광도를 측정하여 표준곡선을 구하였다.
0.1% xanthan gum 수용액 1 ml와 200 μM AlCl3 수용액 1 ml를 1:1 비율로 섞은 후 상온에서 3시간 동안 반응시켰다. 반응된 샘플을 0.20 μm 필터로 여과하였다. 여과된 용액 500 μl를 0.1 M morin hydrate – methanol용액 300 μl과 증류수 200 μl 혼합하여 10분간 상온에서 반응시켰다. 그 후 분광광도계를 이용하여 418 nm 파장의 흡광도를 측정 후 흡광도를 표준곡선에 대입하여 수용액 내의 Al 함량을 측정하였다.
2.5 Morin 염색 및 Al 함량 분석
4일간 생육한 Camelina를 24시간 동안 Al 처리 후 Camelina 뿌리를 채집하였다. 채집된 뿌리를 1차증류수로 5분간 세척 후 상온에서 100 μM morin hydrate 수용액 침지시켜 30분간 염색을 시켰으며 10분간 증류수로 세척하였다. 염색된 샘플들은 현미경을 이용하여 관찰하였다.
Al 함량 분석을 위해서 24시간 동안 Al 처리한 Camelina 뿌리를 채집한 후 3일간 65°C로 건조하였다. 건조된 샘플을 막자와 사발을 이용하여 분쇄하였다. 분쇄된 샘플 0.1 g에 0.1N HNO3를 첨가하여 샘플을 전처리하였다. 전처리된 시료를 희석하여 ICP-OES (Inductively Coupled Plasma Optical Emission Spectroscopy, Avio 500, PerkinElmer, USA)를 이용하여 Al 함량을 측정하였고, Al의 측정한계는 2.9 ng ml-1이다 (Quarles Jr et al. 2018).
2.6 통계 분석
모든 데이터는 SPSS 25 (IBM, USA)를 이용하여 분석을 실시하였다. 데이터의 측정값은 Tukey’s test를 이용하여 사후 분석 비교하였다.
3. 결과
3.1 Xanthan gum 및 Al 처리에 따른 Camelina 뿌리 생장 비교
Xanthan gum에 의한 뿌리의 생장 변화 여부를 관찰하기위해 4일간 생육한 Camelina를 xanthan gum 0, 0.01, 0.05% 농도로 혼합된 1/2 Hoagland solution (pH 4.3, non-phosphorus)으로 이식하여 0, 6, 12, 24 시간에 뿌리생장을 측정하였다. 그 결과, xanthan gum 혼합 유무와 상관없이 24시간까지 뿌리의 생장에 차이가 나지 않았다 (Fig. 1A).
Al 과잉 스트레스에 의한 뿌리 생장 억제를 관찰하기 위해 1/2 Hoagland solution (pH 4.3, non-phosphorus)에 AlCl3를 각각 5, 10 그리고 20 μM 농도로 24시간까지 처리하여 뿌리의 신장을 측정하였다. 그 결과, Al 처리 6시간 후부터 Al 농도가 증가할수록 Al 비스트레스 조건에 비해 뿌리 신장의 차이가 나타나기 시작하였다. 24시간 후에는 Al 처리 농도에 따라 통계적 유의성이 보였으며, 약 47, 75 및 78% 감소하였다 (Fig. 1B).
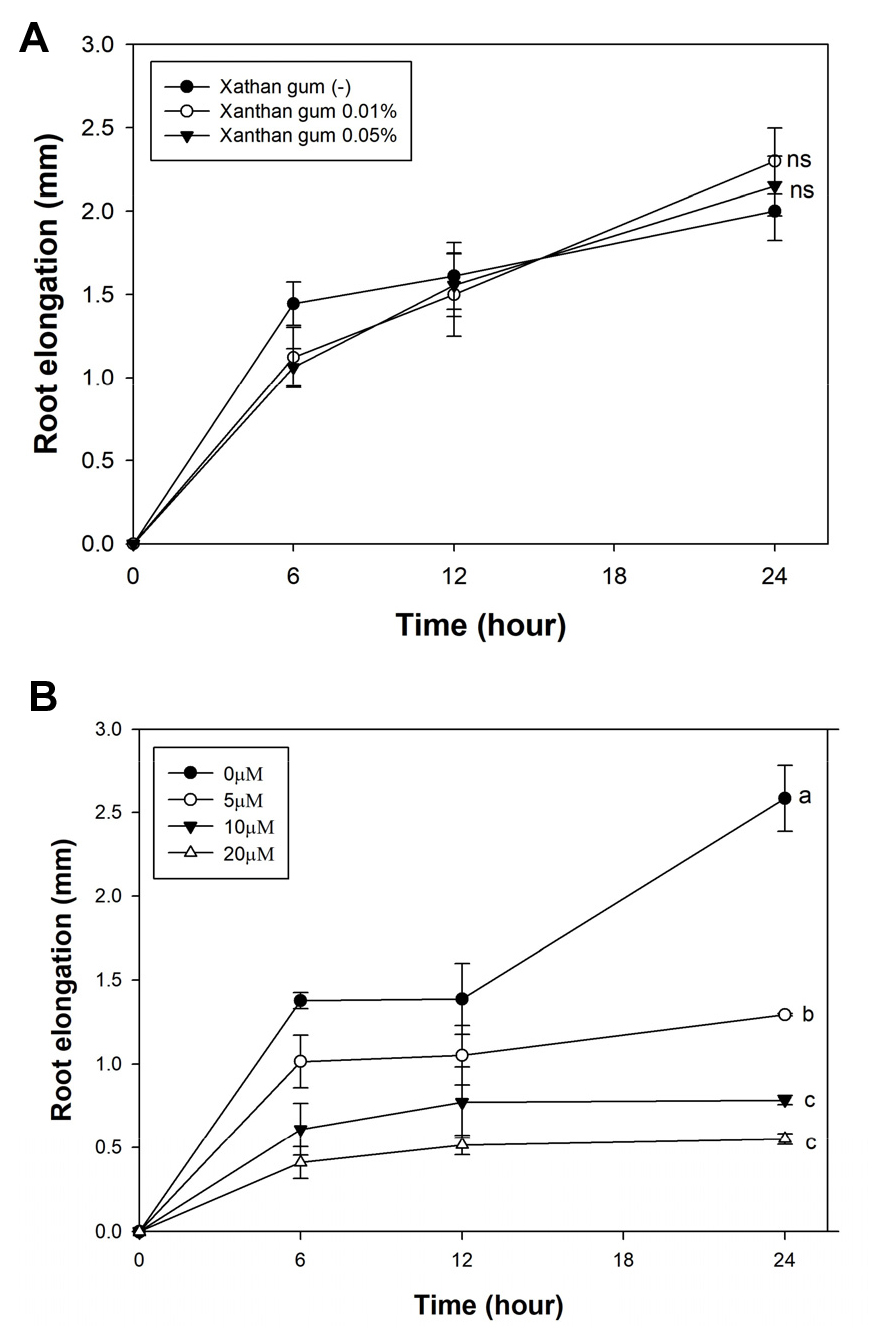
Fig. 1
Root elongation of Camelina under xanthan gum and Al. Camelina grown on half-strength nutrition solution for 4 days. The plants were transplanted to pH-buffered half-strength nutrition solution (-Pi, pH 4.3) with 0 to 0.05% xanthan gum (A) and 0 to 20 μM AlCl3 (B). Root elongation was measured after transplant at 0, 6, 12 and 24 hr. Values are mean SE (n=12 (A), n=3 (B)). The letters indicate the groups that were significantly different (Tukey’s test, P < 0.05).
3.2 Xanthan gum 처리에 따른 Camelina 뿌리 생장
Al 과잉 스트레스 조건에서 xanthan gum혼합에 따른 Camelina뿌리 생장에 미치는 영향을 조사하기 위해 xanthan gum을 0, 0.01, 0.025 및 0.05% 혼합된 용액에 AlCl3 10 μM을 처리한 후 6, 12 그리고 24시간에 뿌리 생장을 측정하였다. 그 결과 Al 과잉 스트레스 조건에서 xanthan gum 비혼합구에 비해 혼합구에서 생장의 증가가 유의성 있게 차이가 났으며, 혼합 농도가 증가할수록 뿌리 생장이 각각 89.4, 124, 143.1% 증가하였다 (Fig. 2A). 또한 Al에 의한 뿌리의 피해를 시각적으로 확인하기 위해 hematoxylin 염색을 수행하였다. Al 비스트레스 조건에서 xanthan gum 비혼합구의 Camelina 뿌리는 hematoxylin 염색이 되지 않은 반면, Al 스트레스 조건의 xanthan gum 비혼합구의 경우, 식물의 뿌리 끝에서부터 3 mm까지 푸르게 염색되었다. Xanthan gum 혼합구들은 농도가 증가할수록 뿌리의 염색 정도가 감소되었으며, 0.05% 농도에서는 뿌리 신장대 부근에서만 옅은 염색이 확인되었다 (Fig. 2B). 이는 xanthan gum의 혼합에 의해 식물 뿌리의 Al 독성 피해가 경감되는 것을 보여주는 결과이다.
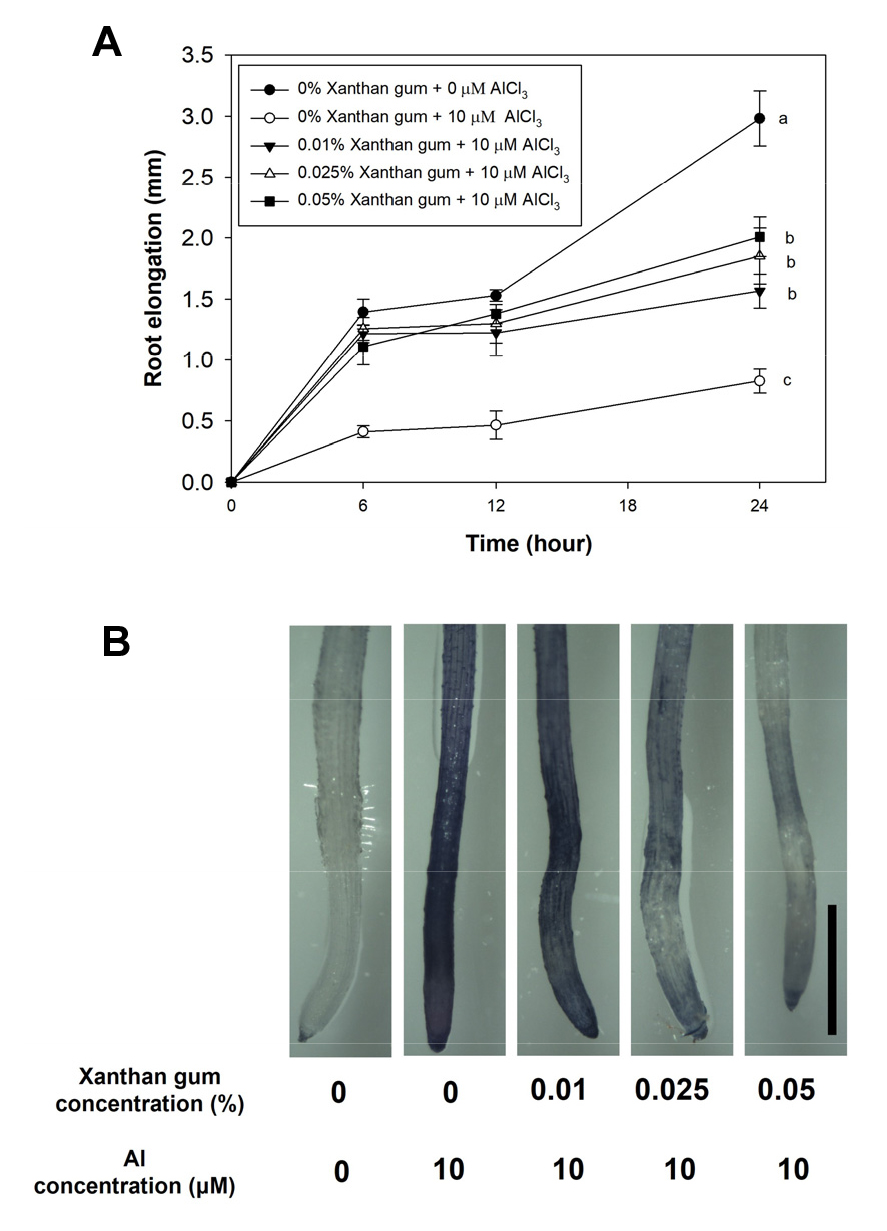
Fig. 2
Effect of xanthan gum concentrations on root elongation. Four-day-old Camelina seedlings were transplanted to pH-buffered nutrition solution (-Pi, pH 4.3) with 0, 0.01, 0.025 and 0.05% xanthan gum and 10 μM AlCl3. Root elongation was measured at 0, 6, 12 and 24 hr (A). The same treated samples were stained by hematoxylin (B). Bar = 1 mm. Values are mean SE (n=8). The letters indicate the groups that were significantly different (Tukey’s test, P < 0.05).
3.3 Xanthan gum 혼합 유무에 따른 ALMT1 유전자 발현 조사
본 실험에서는 Al 과잉 스트레스 조건에서 xanthan gum 혼합에 따른 Camelina의 ALMT1의 발현 수준을 확인하였다. 먼저 Al 노출 시간에 따른 Camelina 뿌리의 ALMT1 발현을 관찰한 결과, Al 비스트레스 조건에서 xanthan gum 혼합 유무와 상관없이 ALMT1의 발현은 일정하였다. 반면, Al 스트레스 조건에서 xanthan gum 혼합구는 ALMT1의 발현이 증가하였지만, xanthan gum 비혼합구에 비해 발현 수준이 약 67% 감소하였다 (Fig. 3).
3.4 Xanthan gum의 Al 이온 결합 분석
이전의 연구에서 xanthan gum을 토양에 혼합하면 토양 내의 2가 양이온인 Zn과 결합하여 식물체내로의 흡수가 감소함과 동시에 Zn 과잉 피해 또한 감소시키는 효과가 보고되었다 (Shin et al. 2020). Al 또한 xanthan gum과 결합하여 식물체 내로의 수송 저하 기능이 있는지를 보기위해, Al과 반응하면 형광을 띠는 morin 염색 시약을 이용하여 확인하였다. 먼저 수용액 내의 Al 농도에 비례하여 morin에 의한 흡광도가 증가하는 것을 확인하였으며 (Fig. 4A), 이 흡광도를 이용하여 수용액 내의 Al 함량을 측정하였다. 그 결과, xanthan gum 비혼합 용액에서는 Al농도가 그대로 측정된 반면 xanthan gum 혼합 용액에서는 Al의 농도가 비혼합구에 비해 69% 감소되었다.
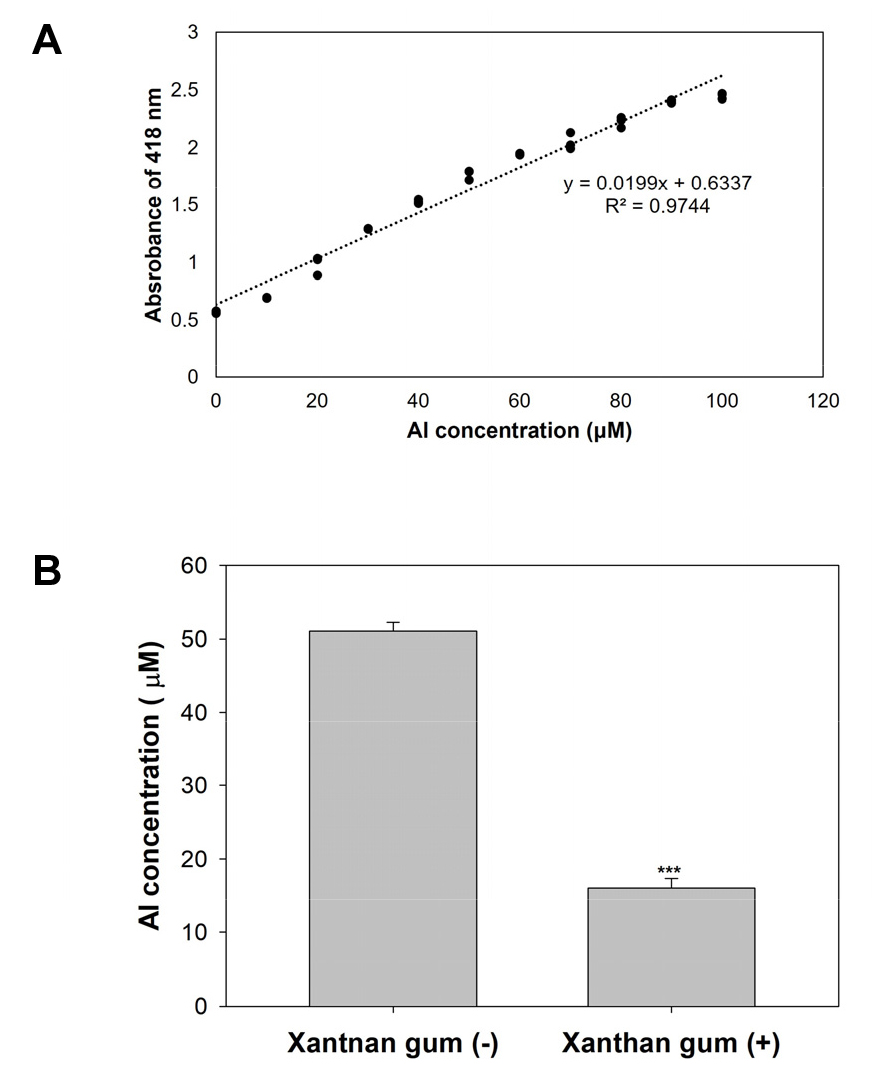
Fig. 4
Al binding capacity of xanthan gum using morin dye. Morin-methanol solution were added 0, 20, 25, 50, 100 and 200 μM AlCl3 of 1:1 ratio. Standard curve was equation by measuring each absorbance (A). 0.05% xanthan gum solution were added 100 μM AlCl3 (B). The solution were incubated for 4h at room temperature. After these were filtered by 0.2 μm filter. Al-morin complex solution were measured absorbance of 418 nm. Values are mean SE (n=3). Asterisks (***) indicate P < 0.001 (student’ t test)
3.5 Xanthan gum 혼합 유무에 따른 Camelina 뿌리의 Al 축적 비교
Al 과잉 스트레스 하에서 Camelina 뿌리내 Al 축적을 확인하기 위해 24시간 동안 Al과 xanthan gum을 처리한 Camelina를 수확하여 morin 염색을 실시한 결과, 비스트레스 조건에서는 xanthan gum 혼합 유무와 상관없이 미약한 형광 신호가 나타났으며, Al 스트레스 조건에서 xanthan gum 비혼합구의 뿌리는 선명한 형광 신호를 보였다. 반면, xanthan gum 혼합구는 Al 비스트레스 조건과 유사한 수준의 형광 신호를 보여주었다 (Fig. 5A). 동일한 조건에서 Camelina 뿌리의 Al 함량을 ICP-OES로 분석한 결과, Al 스트레스 조건에서 xanthan gum 비혼합구의 뿌리가 혼합구 뿌리에 비해 Al 함량이 약 5배 증가하여 morin 염색 실험과 동일한 결과를 보여주었다 (Fig. 5B).

Fig. 5
Effect of xanthan gum on Al accumulation in Camelina root. Camelina were treated with or without 10 μM AlCl3 and xanthan gum 0 or 0.05% for 24 hr, then stained by morin. The morin stained samples were observed using fluorescence microscope (A). Al contents were measured in the same treated root under Al stress (B). Values are mean SE (n=3). Asterisks (**) indicate P < 0.005 (student’ t test).
4. 고 찰
바이오폴리머를 소재로한 제방건설 방법은 실제 토양의 바이오폴리머와 여러가지 환경 스트레스 간의 상호 작용에 대한 연구가 필요하다. 이전의 연구에서 xanthan gum은 Ca, Mg, Zn, Cd, Pb와 같은 2가 금속 양이온들과 결합한다고 보고되어 있으며 (Bergmann et al. 2008), 바이오폴리머 혼합 토양은 가뭄 및 Zn 과잉 스트레스에서 식물 생장의 증진 효과가 보고되었다 (Lim et al. 2018, Shin et al. 2020). Al 또한 전세계적으로 산성 토양에서 식물의 생장을 저해하는 주요 스트레스 인자로 바이오폴리머 혼합 토양에서 Al 스트레스에 의한 식물 생장에 미치는 영향 조사가 매우 중요하다 (von Uexkull and mutert, 1995, Rout et al. 2001). 이에 대한 선행 연구로 Al으로 오염된 군사 시설에 여러가지 바이오폴리머를 혼합하였을 때 식물이 생장 가능한 환경으로 개선되었다고 보고하였다 (Larson et al. 2016). 그러나 xanthan gum과 3가 양이온인 Al의 결합에 의한 Al 오염 토양 개선방법은 보고된 바 없다. 본 연구에서 xanthan gum이 식물 뿌리 생장에 미치는 영향을 조사한 결과, 우선 xanthan gum 처리 유무와 상관없이 뿌리의 생장은 일정하였다 (Fig. 1A). 이전의 연구에서도 xanthan gum이 혼합된 토양에서 Camelina의 생장이 일반 토양과 차이가 나지 않았다 (Shin et al. 2020). 하지만 Al이 처리되면 낮은 농도의 Al에 의해서도 Camelina 뿌리 생장이 급격하게 감소하였다 (Fig. 1B). 이는 Al에 의해 뿌리 생장이 감소한다는 보고들과 일치하였다 (Larsen et al. 2005, Park er al. 2017, Zang et al. 2019). 또한 Al이 처리된 영양액에서 xanthan gum 혼합 시 Camelina 뿌리의 생장이 비 혼합구보다 증가하였다 (Fig. 2A). 또한 본 연구진의 이전 연구에서 Al은 생장하는 뿌리 신장대의 원형질막을 파괴하여 뿌리 생장 억제를 보고하였다 (Ahn et al. 2001, Yamamoto et al. 2001). 본 실험에서 hematoxylin 염색을 통해 세포 수준에서의 Al 독성 피해를 관찰 결과 또한 신장대의 피해가 두드러지게 나타났으며, Al 스트레스 조건에서 xanthan gum 혼합구의 신장대는 그 피해가 감소하였다 (Fig. 2A, B). 이러한 결과는 xanthan gum도 Al 독성 피해를 경감시키며 식물이 생장 가능한 환경으로 개량이 가능한 물질로 보여진다.
Xanthan gum 혼합 유무에 따른 Al 과잉 스트레스 반응을 분자 수준에서 관찰하기 위해, ALMT1 발현 양상을 조사하였다. ALMT1은 malate 수송 단백질로 원형질막에 위치하며, 유기산/H+ antiporter이다. Al에 노출 시 뿌리 끝에서 주로 발현이 유도되며 malate를 방출하여 Al 독성을 방어하는 기작이 보고되어 있다 (Delhaize et al. 1993, Ma et al. 2001, Yamaguchi et al. 2005, Yamaguchi et al. 2005, Godon et al. 2019). 이전의 연구에서 Al 과잉 스트레스 노출 시 Camelina의 뿌리에 malate 수송 단백질인 CsALMT1이 유도된다고 보고되었다 (Park et al. 2017). 본 실험에서도 Al 과잉 스트레스 하에서 xanthan gum 혼합구 및 비혼합구에서 ALMT1의 발현이 모두 유도되었으나, xanthan gum 비혼합구가 혼합구에 비해 발현이 감소됨을 확인하였다 (Fig. 3). 이 결과는, xanthan gum이 Al 독성을 경감시키지만 Al 독성을 완전히 억제시키는 것이 아니기 때문에 근권의 Al을 방어하기 위해 xanthan gum 혼합구에서도 ALMT1의 발현이 유도되는 것으로 보여진다. 이전의 연구에서 Zn 과잉 스트레스 조건에서 xanthan gum 혼합이 Camelina의 생장 증진 및 중금속 수송 관련 유전자인 HMA3의 발현 감소를 확인하였다 (Shin et al. 2020).
Xanthan gum과 AlCl3 수용액을 혼합하여 Al 결합능을 확인한 결과, 혼합 용액에서 Al 이온이 감소하였다 (Fig. 4B). 다른 연구에서 xanthan gum이 Zn 이온과 결합함을 보여주었는데 (Bergmann et al. 2008, Shin et al. 2020), 이는 Al 이온 또한 xanthan gum과 결합을 할 수 있음을 시사한다. 뿌리에 Al 축적되면 morin에 의해 현광 신호가 관찰되며 Al 축적이 낮을수록 낮은 현광신호를 나타낸다 (Lei et al. 2017, Zang et al. 2019). 본 연구에서도 Al 스트레스 하에서 xanthan gum 비혼합구의 뿌리가 강한 형광 신호를 보였지만, xanthan gum 혼합구에서는 현저히 낮은 형광 신호가 나타난 것은 xanthan gum 혼합구 뿌리에 낮은 Al이 축적되었음을 보여주며, ICP-OES 분석결과 또한 xanthan gum 혼합구가 비혼합구에 비해 뿌리 내 Al 함량이 낮았다 (Fig. 5). 이러한 결과들은 xanthan gum이 근권에 있는 Al 이온과 결합하게 되고, 결합된 Al 이온이 아닌 Al 뿌리로의 이행된다. 그 결과, 뿌리 내로 흡수된 Al 함량이 낮아져 세포벽 및 원형질막의 피해가 감소하고 식물의 뿌리 생장이 증진되는 것으로 판단된다.
결론적으로, Al 스트레스 조건에서 xanthan gum이 Al 이온과 결합하여 식물체내로 이행을 억제시키지만, Al 이온을 전부 억제시키지 못하며, 남아있는 Al을 제어하기 위해 식물은 방어 기작으로 ALMT1의 발현을 유도하고 근권의 Al 농도가 감소되어 뿌리 생장이 증진된 것으로 사료된다. 또한 본 연구는 실제 제방에서 일어날 수 있는 Al과 같은 금속 이온 독성 스트레스 조건에서 xanthan gum이 식물에 미치는 Al 독성을 경감시키는 긍정적 효과를 확인하였으며, 바이오폴리머를 이용한 친환경 제방이 식생에 미치는 기초 연구 자료로 이용될 것으로 판단된다.
5. 결 론
본 연구는 친환경 제방 건설 소재로 연구되고 있는 xanthan gum과 주변 식생에 미치는 영향을 조사하고자 하였다. 몇몇 바이오폴리머를 이용하여 Al 오염 토양에서 식물이 자라날 수 있는 환경으로 바꾸는 방법에 대한 연구가 진행되었지만 아직 xanthan gum에 대한 연구는 되어있지 않다. 본 연구에서는 xanthan gum에 의한 식물 뿌리의 Al 독성 피해 경감 효과를 확인하였고, 이는 xanthan gum이 친환경 제방 건설 소재로의 타당성과 환경 친화성에 대한 기초 정보 제공에 유의미한 결과로 판단된다. 또한 xanthan gum은 Al 오염 토양 및 산성 토양에서 안정적인 작물 생산 방법과 Al 오염 토양의 식생 복원 사업에 활용 가능성이 높음을 시사한다. 추가적으로 Al 독성 조건의 실제 토양에서 xanthan gum을 혼합하여 식생에 미치는 영향에 대한 연구가 필요하다.





